Ацетилен к какому классу относится
Содержание:
Ацетилен принадлежит к классу алкинов.
Алкимны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях.
ацетилен реакция соединение формула
Делись добром 😉
Похожие главы из других работ:
2.3.2 Восстановление азотсодержащих органических соединений
Нитросоединения могут быть восстановлены до первичных аминов.
1.3.2 Восстановление азотсодержащих органических соединений
Нитросоединения могут быть восстановлены до первичных аминов.
2. Ик-спектры поглощения органических соединений
При исследовании органических соединений обычно используют поглощение инфракрасного излучения в области 2—50 мкм (5000—200 см-1). Для получения ИК-спектров используются оптические приборы.
3.1 Общая характеристика комплексных соединений хрома (III)
Степень окисления +3 наиболее характерна для хрома. Для этого состояния характерно большое число кинетически устойчивых комплексов.
ГЛАВА 1. ОРГАНИЧЕСКИЕ ВЕЩЕСТВА КЛАССА БАРБИТУРАТОВ
3.3 Спектры поглощения основных классов органических соединений
Глава 1. Понятие оснований, как класса неорганических соединений. Основания в теориях Дж. Бренстеда и Г. Льюиса.
Термин „ основание ” первоначально был отнесен к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов (Ca(OH)2, , , , ). Водные растворы таких оснований, как NaOH, KOH, LiOH.
2.1 Развитие химии органических соединений фтора
История химии фтора начинается не в древнем Египте или Финикии и даже не в средневековой Аравии. Началом возникновения химии фтора послужило открытие фтористого водорода (Шееле, 1771г.) и затем элементарного фтора (Муассан, 1886 г.).
10) Анализ органических соединений
Объектами вольтамперометрического анализа являются не только неорганические вещества или ионы, но и многие органические вещества, способные к электрохимическим превращениям.
3.2 Образование органических соединений, обладающих специфическими свойствами
В ряде случаев в химическом анализе используют такие реакции с участием органических реагентов, в результате которых образуются продукты реакции, обладающие специфическими свойствами — запахом, окрашиванием пламени газовой горелки и т. д. Так.
2.2.2 Спектрометры исследовательского класса для рутинных применений
Уникальный по своим конструктивным особенностям и техническим параметрам спектрофотометр Cary 50 сразу после появления на мировом рынке привлек внимание исследователей.
II. 1. Программа курса профильной ориентации для учащихся 9 класса в рамках предпрофильной подготовки по курсу «Полимеры вокруг нас»
Пояснительная записка Программа элективного курса «Полимеры вокруг нас» предназначена для предпрофильной подготовки учащихся 9 класса с ориентацией на химико — биологический профиль.
1.4 Получение органических соединений окислительным метилированием
Использование метана в качестве метилирующего агента в реакциях типа (1) термодинамически запрещено. RH + CH4 > RCH3+ H2, (1) Это связано с тем, что молекула метана имеет тетраэдрическое строение, в котором углеродный атом.
1.2 Характеристика класса препарата
Противовирусные препараты — соединения природного или синтетического происхождения, применяющиеся для лечения и профилактики вирусных инфекций.
7. Классы органических соединений
В каждом из типов углеродного скелета все соединения распределяются по классам в зависимости от входящих в их состав функциональных групп. Функциональной группой называют атом или группу атомов.

Ацетилен
Название этого вещества связано со словом «уксус». Сегодня это единственный широко используемый в промышленности газ, горение и взрыв которого возможны в отсутствие кислорода или других окислителей. Сгорая в кислоте, он дает очень горячее пламя — до 3100°С.
Как синтезировался ацетилен
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + 2Н2О=С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Этот газ был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3 ацетилом.
На латыни acetum – уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила. Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом. Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 – Н = С2Н2. Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку. В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами. Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С = СаС2 + СО. Это произошло в конце XIX века.
Тогда ацетилен стали использовать для освещения. В пламени при высокой температуре этот газ, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому).
Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина, арсина.
Ацетилен сегодня: способы получения
В промышленности ацетилен часто получают действием воды на карбид кальция.
Сейчас широко применяются методы получения ацетилена из природного газа – метана:
электрокрекинг (струю метана пропускают между электродами при температуре 1600°С и быстро охлаждают, чтобы предотвратить разложение ацетилена);
термоокислительный крекинг (неполное окисление), где в реакции используют теплоту частичного сгорания ацетилена.
Применение
Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды,
- в производстве взрывчатых веществ,
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
Свойства ацетилена
В химически чистом виде ацетилен обладает слабым эфирным запахом. Технический ацетилен, благодаря наличию в нем примесей, в частности фосфористого водорода, имеет резкий специфический запах. Ацетилен легче воздуха. Газообразный ацетилен – бесцветный газ молекулярная масса – 26,038.
Ацетилен способен растворяться во многих жидкостях. Его растворимость зависит от температуры: чем ниже температура жидкости, тем больше она способна «забрать» ацетилена. В практике производства растворенного ацетилена используют ацетон, который при температуре 15 °С растворяет до 23 объемов ацетилена.
Содержание фосфористого водорода в ацетилене должно быть строго ограничено, так как в момент образования ацетилена в присутствии воздуха при высокой температуре может произойти самовоспламенение.
Ацетилен — единственный широко используемый в промышленности газ, относящийся к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Еще в 1895 г. А.Л.Ле Шателье обнаружил, что ацетилен, сгорая в кислоте, дает очень горячее пламя (до 3150°С), поэтому его широко используют для сварки и резки тугоплавких металлов. Сегодня применение ацетилена для газопламенной обработки металлов испытывает сильную конкуренцию со стороны более доступных горючих газов (природный газ, пропан–бутан и т.д.). Однако преимущество ацетилена — в самой высокой температуре горения. В таком пламени очень быстро расплавляются даже толстые куски стали. Именно поэтому газопламенная обработка ответственных узлов машиностроительных конструкций производится только с помощью ацетилена, который обеспечивает наивысшую производительность и качество процесса сварки.
Кроме того, ацетилен широко используется в органическом синтезе разнообразных веществ — уксусного альдегида и уксусной кислоты, синтетических каучуков (изопренового и хлоропренового), поливинилхлорида и других полимеров.
ПЕРЕВОЗКА. Техническим растворенным ацетиленом наполняют стальные баллоны для растворенного ацетилена с пористой массой (активным углем или литой пористой массой) и ацетоном. Баллоны окрашены в белый цвет и оснащены вентилями специальных типов, предназначенными для ацетиленовых баллонов. Растворенный ацетилен в баллонах перевозят всеми видами транспорта в соответствии с правилами перевозки опасных грузов, действующими на данном виде транспорта.
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2H2 обнаружен на Уране и Нептуне.
Химические свойства


Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
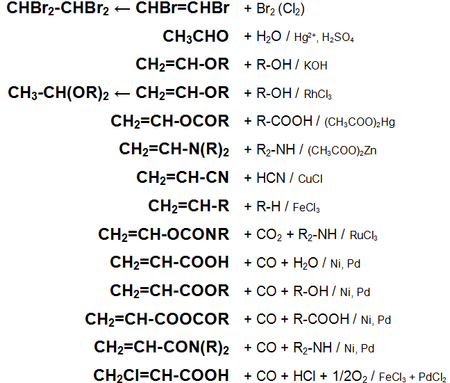
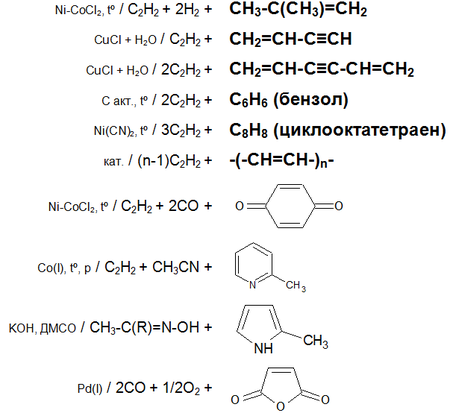
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Применение


- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком) [2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м 3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.



Отправить ответ