Атомно кристаллическая структура металлов
Под атомно-кристаллической структурой понимают взаимное расположение атомов (ионов), существующее в реальном кристалле.
В твердом состоянии металл представляет собой постройку, состоящую из положительно заряженных ионов, омываемых «газом» из свободных коллективизированных электронов. Связь в металле осуществляется электростатическими силами. Между ионами и коллективизированными электронами проводимости возникают электростатические силы притяжения, которые стягивают ионы. Такая связь называется металлической.
Силы связи в металлах определяются силами отталкивания и силами притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии один от другого, при котором энергия взаимодействия минимальна.

Рис1. Схема энергии взаимодействия двух атомов в зависимости от межатомного расстояния
Поэтому в металле атомы располагаются закономерно, образуя правильную кристаллическую решетку, что соответствует минимальной энергии взаимодействия атомов.
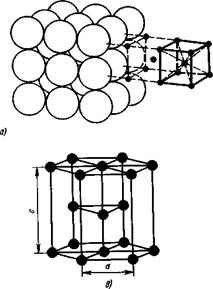
Кристаллическая решетка состоит из воображаемых линий и плоскостей, проходящих через точки расположения ионов в пространстве. Жирными линиями выведен наименьший параллелепипед, последовательным перемещением которого вдоль трех своих осей может быть построен весь кристалл.
Этот наименьший объем кристалла, дающий представление об атомной структуре металла в любом объеме, получил название элементарной кристаллической ячейки.
Для однозначной ее характеристики необходимо знать следующие величины: три ребра (а, в и с) и три угла между осями a, b, g.
Большинство металлов образует одну из следующих высокосимметричных решеток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
Как видно в кубической объемно центрированной решетке (ОЦК) атомы расположены в вершинах куба и один атом в центре объема куба. Кубическую объемно центрированную решетку имеют металлы: РЬ, К, Na, Li, Tig, Zrp, Та, W, V, Fea, Cr, Nb, Ba и др.


А б
Рис 2. Кристаллические решетки металлов:
а — объемно центрированная кубическая (ОЦК), б — гранецентрированная кубическая (ГЦК); в- гексагональная плотноупакованная (ГПУ)
В кубической гранецентрированной решетке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани (рис. 6, б). Решетку такого типа имеют металлы: Саа, Се, Sra, Tn, Pb, N1, Ag, Au, Pd, Pt, Rh, Jr, FeT, Си, Соа и др.
В гексагональной решетке (рис. 6, в) атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, Tia, Cd, Re, Os, Ru, Zn, Cop, Be, Cap и др.
Расстояния a, b, с между центрами ближайших атомов в элементарной ячейке называются периодами решетки. Период решетки выражается в нанометрах (1 нм = 10 -9 см).
Периоды решетки для большинства металлов находятся в пределах 0,1—0,7 нм.
Плотность кристаллической решетки — объема, занятого атомами, которые условно можно рассматривать как жесткие шары (см. рис.2), характеризуется координационным числом, под которым понимают число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше координационное число, тем больше плотность упаковки атомов.
В элементарной ячейке объемно центрированной кубической решетки наименьшее расстояние между атомами находятся 8 соседей. Следовательно, координационное число для ОЦК решетки соответствует 8 и обозначается К8. Коэффициент компактности ячейки, определяемый как отношение объема, занятого атомами, к объему ячейки составляет для ОЦК решетки 68 % .
Для гранецентрированной кубической решетки координационное число равно 12 (К12); каждый_атом имеет 12 ближайших соседей на расстоянии рис.2 , что соответствует наибольшей плотности упаковки или укладки в виде шаров. Гексагональная плотноупакованная решетка, для которой с/а = = 1,633, имеет координационное число 12 (Г12), что также соответствует наибольшей плотности упаковки шаров (атомов).
Половину наименьшего расстояния между атомами в их кристаллической решетке называют атомным радиусом. Атомный радиус возрастает при уменьшении координационного числа, так как при этом увеличивается пространство между атомами. Поэтому атомные радиусы разных металлов обычно приводятся к К12.
Кристаллографические обозначения атомных плоскостей. Для определения положения атомных плоскостей (проходящих через атомы) в кристаллических пространственных решетках пользуются индексами h, k, l, представляющими собой три целых рациональных числа, являющихся величинами, обратными отрезкам осей, отсекаемым данной плоскостью на осях координат. Единицы длины вдоль осей выбирают равными длине ребер элементарной ячейки. Эти числа заключают в круглые скобки.
Приведем примеры обозначения плоскостей. Установим первоначально индексы для плоскости куба.
Вследствие неодинаковой плотности атомов в различных плоскостях и направлениях решетки свойства (химические, физические, механические) каждого монокристалла зависят от направления вырезки образца по отношению к направлениям в решетке. Подобная неодинаковость свойств монокристалла в разных кристаллографических направлениях называется анизотропией.
Кристалл — тело анизотропное в отличие от аморфны к тел (стекло, пластмассы и др.), свойства которых не зависят от направления.
Технические металлы являются поликристаллами, т. e. состоят из большого числа анизотропных кристаллитов. В большинстве случаев кристаллиты статистически неупорядоченно ориентированы по отношению друг к другу; поэтому во всех направлениях свойства более или менее одинаковы, т. е. поликристаллическое тело является псевдоизотропным. Такая мнимая изотропность металла не будет наблюдаться, если кристаллиты имеют одинаковую преимущественную ориентацию в каких-то направлениях. Эта ориентированность, или текстура, создается в известной степени, но не полностью (например, в результате значительной холодной деформации); в этом случае поликристаллический металл приобретает анизотропию свойств.
ДЕФЕКТЫ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ МЕТАЛЛОВ
В любом реальном кристалле всегда имеются дефекты строения. Дефекты кристаллического строения подразделяют по геометрическим признакам на :
 1-точечные (нульмерные), 2- линейные (одномерные), 3- поверхностные (двумерные).
1-точечные (нульмерные), 2- линейные (одномерные), 3- поверхностные (двумерные).


Точечные дефекты. Малы во всех трех измерениях, и размеры их не превышают нескольких атомных радиусов.
вакансии, межузельные атомы, точечные несовершенства (присутствие атомов примесей)
Линейные дефекты – Малы в двух измерениях и большая протяженность в третьем.
Краевая дислокация— наличие «лишней» атомной полуплоскости.
Винтовая дислокация – прямая линия вокруг которой атомные плоскости изогнуты по винтовой поверхности.
Поверхностные дефекты.Эти дефекты малы только в одном измерении. Они представляют собой поверхности раздела между отдельными зернами или субзернами в поликристаллическом металле; к ним относятся также дефекты упаковки.
Поликристалл состоит из большого числа зерен, при этом в соседних зернах кристаллические решетки ориентированы различно. Границы между зернами называют больше у еловыми, так как кристаллографические направления в соседних зернах образуют углы, достигающие десятков градусов.
Каждое зерно металла состоит из отдельных субзерен, образующих так называемую субструктуру. Субзерна разориентированы относительно друг друга от нескольких долей до единиц градусов — малоугловые границы.

Границы между отдельными кристаллами (зернами) обычно представляют переходную область шириной до 3—4 межатомных расстояний, в которой решетка одного кристалла, имеющего определенную кристаллографическую ориентацию, переходит в решетку другого кристалла, имеющего иную кристаллографическую ориентацию. Поэтому на границе зерна в переходной области атомы расположены иначе, чем в объеме зерна. Кроме того, по границам зерен в технических металлах концентрируются примеси, что еще больше нарушает правильный порядок расположения атомов. Несколько меньшие нарушения наблюдаются на границах субзерен.
Под атомно-кристаллической структурой понимают взаимное расположение атомов, существующее в кристалле. Атомы в кристалле расположены в определенном порядке, который периодически повторяется в трех измерениях.
Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки.
Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узле которой располагаются атомы (ионы), образующие металл.
Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, получил название элементарной кристаллической ячейки (решетки).
Для характеристики элементарной ячейки задают шесть величин: три ребра ячейки a, b, c и три угла между ними α, β, γ. Эти величины называют параметрами кристаллической решетки.
Кристаллические решетки бывают простыми (атомы только в вершинах решетки) и сложными.
Металлы образуют одну из следующих высокосимметричных сложных решеток с плотной упаковкой атомов: кубическую объемноцентрированную (ОЦК), кубическую гранецентрированную (ГЦК) и гексагональную (ГПУ) (рис. 2).

ОЦК: Rb, K, Na, Li, Tiβ, Tlβ, Zrβ, Ta, W, V, Feα, Cr, Nb, Ba, и др.
ГЦК: Cu, Al, Pt, Pb, Ni, Ag, Au, Pd, Rh, Ir, Feγ, Coα, Caα, Ce, Srα, Th, Sc и др.
Расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку, называют периодом решетки, измеряется в нанометрах (1нм = 10 -9 см = Å= 10 -8 см).
Периоды решетки металлов находятся в пределах 0,2 – 0,7 нм.
Для ОЦК: a, b, c; a = b = c.
Для ГЦК: a, b, c; a = b = c.
Для ГПУ: а, с; с/а = 1,633 (к Zn не относится)
Число атомов в каждой элементарной ячейке (плотность упаковки – равняется числу атомов, приходящихся на одну элементарную ячейку):
ОЦК: ПУ (плотноупакованная) =  ;
;
ГЦК: ПУ =  ;
;
ГПУ: ПУ =  .
.
Координационное число – под ним понимают число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше координационное число, тем больше плотность упаковки атомов:
ОЦК: расстояние (min) между атомами  , на этом расстоянии от рассматриваемого атома находится 8 соседей – К8 .
, на этом расстоянии от рассматриваемого атома находится 8 соседей – К8 .
ГЦК: 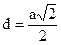 , К12.
, К12.
ГПУ: Г12 (с/а = 1,633).
Коэффициент заполнения ячейки (плотность укладки) – определяется как отношение объема, занятого атомами к объему ячейки:
Для характеристики величины атома служит атомный радиус, под которым понимается половина расстояния между ближайшими соседними атомами. Атомный радиус возрастает при уменьшении координационного числа.
2.Для большинства металлов характерны следующие типы кристаллических решеток: объемно-центрированная кубическая (ОЦК); гранецентрированная кубическая (ГЦК); гексагональная плотноупакованная (ГПУ). Основные типы кристаллических решеток представлены на рис. 2.4. В объемно-центрированной кубической решетке (рис. 2.4, а) атомы расположены в углах и центре куба. Период решетки равен а, координационное число К= 8, базис решетки равен 2; 8 атомов расположены в углах куба, 1 атом в центре куба принадлежит только одной ячейке). Данный тип решетки имеют металлы К, Na, Li, Та, W, Mo, Fea, Cr, Nb и др.
В гранецентрированной кубической решетке (рис. 2.4, б) атомы расположены в углах куба и центрах его граней. Эта решетка характеризуется периодом а, координационном числом К= 12, базисом, равным 4: (1/8) • 8 + ½ • 6 = 4; 8 атомов в углах куба и 6 атомов в центрах граней, каждый из которых принадлежит двум элементарным ячейкам. Кубическую гранецентрированную решетку имеют следующие металлы: Са, Pb, Ni, Ag, Au, Pt, FeY и др.
В гексагональной плотноупакованной решетке (рис. 2.4, в) атомы расположены в вершинах и центрах шестигранных оснований призмы, кроме того, три атома находятся в средней плоскости призмы. Периоды решетки — а и с, причем с/а > 1 (например, с/а = 1,633 для Ru, Cd и с/а > 1,633 для Mg, Zn), координационное число К= 12, базис решетки равен 6.

3.Дефекты кристаллического строения
Точечные дефекты-это такие нарушения периодичности кр. реш., размеры которых во всех трех измерениях малы и сопоставимы с размерами атомов:
-вакансии-узлы кр. реш., не занятые атомами
-межузельные атомы – атомы, расположенные в межатомных пустотах
-примесные атомы: занимают позиции замещения и внедрения
Точечные дефекты определяют возможность диффузии, т.е. перемещения атомов в кр. реш. на расстояния превышающие межатомные
Линейные дефекты – имеют малые размеры в двух измерениях и большую протяженность в третьем измерении:
-краевая дислокация-фронтальная граница неполной атомной плоскости
-винтовая дислокация-это линия, вокруг которой атомная плоскость образует винтовую поверхность
Плотность дислокаций-суммарная длина всех линий дислокаций в единице объема
Поверхностные дефекты – малы в одном измерении и протяженны в двух других:
-границы зёрен – поверхности раздела между отдельными зернами.
-границы субзерен- состоят из параллельных краевых дислокаций, расположенных друг над другом и дробят зерно на на отдельные субзерна.
-двойниковые границы –это плоскости двойникования, делящие кристалл на две части с зеркально симметричным расположением атомов
— дефекты упаковки- части атомной плоскости, ограниченной дислокациями, в которой нарушено закономерное чередование плотноупакованных слоев атомов.
-макроскопические дефекты: поры, трещины, частицы инородных фаз.
-тепловые колебания атомов, создающие упругие волны, которые являются причиной локальных непрерывно изменяющихся динамических искажений решетки
-зональные упругие напряжения 1-го рода, возникающие в макрообъемах кристалла при внешних воздействиях(например из-за неравномерности охлаждения)
1.Переход из жидкого состояния в твердое (кри-сталлическое) называют кристаллизацией. Процессы кристаллизации зависят от температу-ры и протекают во времени, поэтому кривые ох-лаждения строятся в координатах температу-ра — время (рис. 3). Теоретический, т. е. идеаль-ный процесс кристаллизации металла без пере-охлаждения протекает при температуре Т 5 (рис. 3). При достижении идеальной температу-ры затвердевания Т 5 падение температуры пре-кращается. Это объясняется тем, что перегруп-пировка атомов при формировании кристаллической решетки идет с выделением тепла (выде-ляется скрытая теплота кристаллизации). Каждый чистый металл (не сплав) кристаллизуется при строго индивидуальной постоянной темпера-туре. По окончании затвердевания металла тем-пература его снова понижается.
Практически кристаллизация протекает при более низкой температуре, т. е. при переохлажде-нии металла до температур Tn, Tn 1, Tn 2 (напри-мер, кривые 1, 2). Степень переохлаждения (ДT=T s —Tn) зависит от природы и чистоты ме-талла к скорости охлаждения. Чем чище жидкий металл, тем он более склонен к переохлаждению. При увеличении скорости охлаждения степень переохлаждения возрастает, а зерна металла ста-новятся мельче, что улучшает его качество. Для большинства металлов степень переохлаждения при кристаллизации в производственных усло-виях составляет от 10 до 30°С. При больших скоростях охлаждения она может достигать со-тен градусов.
Процесс кристаллизации состоит из двух ста-дий: зарождения — кристаллов (зародышей или центров кристаллизации) и роста кристаллов из этих центров. При переохлаждении сплава ниже Tn на многих участках жидкого металла (рис. 4, а, б) образуются способные к росту кри-сталлические зародыши.
Сначала образовавшие-ся кристаллы растут свободно и имеют более или менее правильную геометрическую форму (рис. 4, в, г, д). Затем при соприкосновении рас-тущих кристаллов их правильная форма нару-шается, так как в этих участках рост граней пре-кращается. Рост кристалла продолжается только в тех направлениях, где есть свободный доступ жидкого металла. В результате кристаллы, имев-шие сначала геометрически правильную форму, после затвердевания получают неправильную форму, их называют кристаллитами или зернами (рис. 4,е).
Величина зерен зависит от числа центров кри-сталлизации и скорости роста кристаллов. Чем больше центров кристаллизации, тем мельче зерно металла.
Величина зерен, образующихся при кристалли-зации, зависит не только от количества самопро-извольно зарождающихся центров кристаллиза-ции, но также и от количества нерастворимых примесей, всегда имеющихся в жидком металле. Такие нерастворимые примеси являются готовы-ми центрами кристаллизации. Ими являются окислы (например, Al2O3), нитриды, сульфиды и другие соединения. Центрами кристаллизации в данном металле или сплаве могут быть только такие твердые частицы, которые соизмеримы с размерами атомов основного металла. Кристал-лическая решетка таких твердых частиц должна быть близка по своему строению и параметрам решетке кристаллизующегося металла. Чем боль-ше таких частичек, тем мельче будут зерна за-кристаллизовавшегося металла.
На образование центров кристаллизации вли-яет и скорость охлаждения. Чем выше скорость охлаждения, тем больше возникает центров кри-сталлизации и, следовательно, мельче зерно ме-талла.
Чтобы получить мелкое зерно, создают искус-ственные центры кристаллизации. Для этого в расплавленный металл (расплав) вводят специ-альные вещества, называемые модификаторами. Модифицирование отливок проводят введением в расплав добавок, которые образуют тугоплавкие соединения (карбиды, окислы). При модифицировании, например, ста-ли применяют алюминий, титан, ванадий; алю-миниевых сплавов — марганец, титан, ванадий.
Дата добавления: 2016-11-02 ; просмотров: 932 | Нарушение авторских прав


1. Атомно-кристаллическое строение металлов
Все металлы и металлические сплавы, полученные обычными способами, представляют собой поликристаллические тела, состоящие из различно ориентированных по отношению друг к другу кристаллов. Эти кристаллы, вследствие взаимного столкновения в процессе кристаллизации, имеют неправильную форму и называются кристаллитами или зернами . На кристалличность металлов — самородных меди и золота — и сходство их кристаллов с кристаллами солей обратил внимание в шестидесятых годах 18-го столетия гениальный русский ученый Михаил Васильевич Ломоносов . Понятие о кристалличности металлов и сплавов легло в основу современного научного объяснения их прочностных и пластических свойств. Атомы (ионы) в кристаллах расположены закономерно.
При особых условиях металлы и сплавы могут быть получены в аморфном состоянии. Атомы в аморфных телах расположены хаотично.
В дальнейшем, вместо выражения "металлы и сплавы" в тексте возможно использование термина "металлы" , что соответствует принятой терминологии. Попутно отметим, что все металлы и сплавы условно подразделяют на две группы. Железо и сплавы на его основе, т.е. сталь и чугун, называют черными металлами , а остальные металлы и их сплавы — цветными .
Атомы в кристалле, располагаясь в определенном порядке, образуют кристаллическую решетку. Эта решетка представляет собою воображаемую пространственную сетку, в узлах которой находятся положительно заряженные ионы, а между ними — свободные электроны, получившие название электронного газа .
Расположение атомов в кристалле обычно изображают в виде пространственных так называемых элементарных кристаллических ячеек, перемещением которых можно воспроизвести пространственную кристаллическую решетку. Наиболее распространены три типа кристаллических решеток :
Расстояния между центрами ближайших атомов в элементарной ячейке называются периодами решетки .
В ОЦК решетке каждый атом в вершине куба одновременно принадлежит восьми элементарным ячейкам. Следовательно, на одну элементарную ячейку ОЦК решетки приходится два атома: из них один атом находится в центре куба, а один вносят атомы, расположенные в вершинах куба. Аналогичным образом можно показать, что на одну элементарную ячейку ГЦК решетки приходится четыре атома, а на одну ячейку ГПУ решетки — шесть атомов.
 |
|---|
Важной характеристикой кристаллической решетки является ее плотность , т.е. объем, занятый атомами. Атомы при этом рассматриваются как жесткие шары. Плотность характеризуется координационным числом — числом атомов, находящихся на равном и наименьшем расстоянии от одного, так называемого базисного, атома.
На рис. 1 приведена схема кубической объемноцентрированной решетки, где за базисный атом взят атом, расположенный в центре куба. Видно, что на равном и ближайшем расстоянии от него находится 8 атомов, расположенных в вершинах куба. Таким образом, координационное число для этой решетки 8 (обозначается К8), а коэффициент заполнения, т.е. отношение объема, занятого атомами, к объему ячейки, составит 68%.
Чем больше координационное число решетки, тем выше плотность упаковки атомов. Для гранецентрированной кубической и гексагональной плотноупакованной решеток координационное число 12 (принятое обозначение К12 и Г12). Эти решетки являются наиболее компактными. Коэффициент заполнения в них составляет 74%.
В специальной литературе рассматриваются такие вопросы, как кристаллографические обозначения атомных плоскостей кристаллов и индексы направлений, что необходимо, например, при объяснении такого характерного для металлических кристаллов свойства, как анизотропия , — неодинаковость многих свойств — физических, химических, механических — по разным кристаллографическим направлениям. Связано это с тем, что различные плоскости заполнены атомами с различной плотностью. В качестве примера рассмотрим две плоскости в объемноцентрированной кубической решетке: плоскость куба и плоскость, проходящую через элементарную ячейку (рис. 2).
 |
|---|
Четыре атома, расположенные в вершинах квадрата, вносят в плоскость куба один атом, поскольку каждый из этих атомов в совокупности с соседними ячейками принадлежит четырем плоскостям. Следовательно, плотность атомов в плоскости куба составит 1/a 2 (а — период решетки). Плотность атомов в плоскости, проходящей через элементарную ячейку, как нетрудно показать, составит  , т.е. в
, т.е. в  раз будет больше.
раз будет больше.



Отправить ответ