Диоксид углерода что это такое
Содержание:
- 1 Физические свойства.
- 2 Химические свойства.
- 3 Распространенность в природе и получение.
- 4 ПРИМЕНЕНИЕ
- 5 Получение низких температур.
- 6 Карбонизация.
- 7 Применения, основанные на инертности.
- 8 Химические аспекты.
- 9 Создание повышенного давления.
- 10 Применение в медицине.
- 11 Свойства диоксида углерода, получение
- 12 Как применяется диоксид углерода
- 13 Как влияет диоксид углерода на организм человека
УГЛЕРОДА ДИОКСИД (оксид углерода(IV), ангидрид угольной кислоты, углекислый газ) CO2, хорошо известный пузырящийся ингредиент газированных безалкогольных напитков. Человек знал о целебных свойствах «шипучей воды» из природных источников с незапамятных времен, но только в 19 в. научился получать ее сам. Тогда же было идентифицировано вещество, делающее воду шипучей, – углекислый газ. Впервые для целей карбонизации этот газ был получен в 1887 в ходе реакции между измельченным мрамором и серной кислотой; его выделяли и из природных источников. Позже СО2 стали получать в промышленных масштабах сжиганием кокса, прокаливанием известняка и брожением спирта. Более четверти века диоксид углерода хранили в стальных баллонах под давлением и использовали почти исключительно для газирования напитков. В 1923 как коммерческий продукт стали производить твердый СО2 (сухой лед), а примерно в 1940 – жидкий, который разливали в специальные герметичные цистерны под высоким давлением.
Физические свойства.
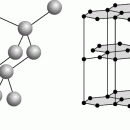
При обычных температуре и давлении диоксид углерода – бесцветный, обладающий слегка кисловатым вкусом и запахом газ. Он на 50% тяжелее воздуха, поэтому его можно переливать из одной емкости в другую. СО2 – продукт большинства процессов горения и при достаточно больших количествах может гасить пламя, вытесняя из воздуха кислород. При увеличении концентрации СО2 в плохо проветриваемом помещении содержание кислорода в воздухе уменьшается настолько, что человек может задохнуться. СО2 растворяется во многих жидкостях; растворимость зависит от свойств жидкости, температуры и давления паров СО2. Способность диоксида углерода растворяться в воде и определяет его широкое использование в производстве безалкогольных напитков. СО2 прекрасно растворяется в органических растворителях, например в спирте, ацетоне и бензоле.
При повышении давления и охлаждении диоксид углерода легко сжижается и находится в жидком состоянии при температурах от +31 до –57° С (в зависимости от давления). Ниже –57° С переходит в твердое состояние (сухой лед). Давление, необходимое для сжижения, зависит от температуры: при +21° С оно составляет 60 атм, а при –18° С всего 20 атм. Жидкий СО2 хранят в герметичных емкостях под соответствующим давлением. При переходе в атмосферу часть его превращается в газ, а некоторое количество – в «углеродный снег», при этом его температура понижается до –84° С.
Поглощая тепло из окружающей среды, сухой лед переходит в газообразное состояние, минуя жидкую фазу, – сублимирует. Для уменьшения сублимационных потерь его хранят и транспортируют в герметичных контейнерах, достаточно прочных, чтобы выдержать увеличение давления при повышении температуры.
Химические свойства.
СО2 – малоактивное соединение. При растворении в воде образует слабую угольную кислоту, окрашивающую лакмусовую бумажку в красный цвет. Угольная кислота улучшает вкусовые качества газированных напитков и предотвращает рост бактерий. Реагируя со щелочными и щелочноземельными металлами, а также с аммиаком, СО2 образует карбонаты и бикарбонаты. См. также УГЛЕРОД.
Распространенность в природе и получение.

СО2 образуется при сжигании углеродсодержащих веществ, спиртовом брожении, гниении растительных и животных остатков; он высвобождается при дыхании животных, его выделяют растения в темноте. На свету, напротив, растения поглощают СО2 и выделяют кислород, что поддерживает природный баланс кислорода и углекислого газа в воздухе, которым мы дышим. Содержание СО2 в нем не превышает 0,03% (по объему).
Известно пять основных способов получения СО2: сжигание углеродсодержащих веществ (кокса, природного газа, жидкого топлива); образование в качестве побочного продукта при синтезе аммиака; прокаливание известняка; брожение; откачка из скважин. В последних двух случаях получается практически чистый диоксид углерода, а при сжигании углеродсодержащих веществ или прокаливании известняка образуется смесь СО2 с азотом и следами других газов. Эту смесь пропускают через раствор, поглощающий только СО2. Затем раствор нагревают и получают практически чистый СО2, который отделяют от оставшихся примесей. От паров воды избавляются вымораживанием и химической сушкой.
Очищенный СО2 сжижают, охлаждая его при высоком давлении, и хранят в больших емкостях. Для получения сухого льда жидкий СО2 подают в закрытую камеру гидравлического пресса, где понижают давление до атмосферного. При резком снижении давления из СО2 образуются рыхлый снег и очень холодный газ. Снег прессуют и получают сухой лед. Газообразный СО2 откачивают, сжижают и возвращают в резервуар для хранения.
ПРИМЕНЕНИЕ
Получение низких температур.
В жидком и твердом виде СО2 применяется в основном как хладагент. Сухой лед – компактный материал, удобный в обращении и позволяющий создавать разные температурные режимы. При той же массе он превосходит обычный лед по хладоемкости более чем в два раза, занимая вдвое меньший объем. Сухой лед используется при хранении пищевых продуктов. Им охлаждают шампанское, безалкогольные напитки и мороженое. Он широко применяется при «холодном измельчении» термочувствительных материалов (мясных продуктов, смол, полимеров, красителей, инсектицидов, красок, приправ); при галтовке (очистке от заусенцев) штампованных изделий из резины и пластика; при низкотемпературных испытаниях летательных аппаратов и электронных устройств в специальных камерах; для «холодного смешивания» полуфабрикатов кексов и тортов, чтобы при выпечке они сохраняли однородность; для быстрого охлаждения контейнеров с транспортируемыми продуктами обдуванием их струей измельченного сухого льда; при закалке легированных и нержавеющих сталей, алюминия и т.д. с целью улучшения их физических свойств; для плотной посадки деталей машин при их сборке; для охлаждения резцов при обработке высокопрочных стальных заготовок.
Карбонизация.
Основное применение газообразного СО2 – карбонизация воды и безалкогольных напитков. Вначале воду и сироп смешивают в нужных пропорциях, а затем под давлением насыщают смесь газообразным СО2. Карбонизация пива и вин обычно происходит в результате протекающих в них химических реакций.
Применения, основанные на инертности.
СО2 применяется как антиоксидант при долговременном хранении многих пищевых продуктов: сыра, мяса, сухого молока, орехов, растворимых чая, кофе, какао и т.д. Как вещество, подавляющее горение, СО2 используют при хранении и транспортировке горючих материалов, например ракетного топлива, масел, бензина, красок, лаков, растворителей. Он используется как защитная среда при электросварке углеродистых сталей с целью получения однородного прочного шва, при этом сварочные работы оказываются дешевле, чем при использовании инертных газов.
СО2 – одно из наиболее эффективных средств тушения пожаров, возникающих при воспламенении горючих жидкостей и электрических пробоях. Выпускают разные углекислотные огнетушители: от портативных емкостью не более 2 кг до стационарных установок автоматической подачи с общей емкостью баллонов до 45 кг или газовых резервуаров низкого давления емкостью до 60 т СО2. Жидкий СО2, находящийся в таких огнетушителях под давлением, при выпуске образует смесь из снега и холодного газа; последний обладает большей плотностью, чем воздух, и вытесняет его из зоны горения. Эффект усиливается еще и охлаждающим действием снега, который, испаряясь, переходит в газообразный СО2.
Химические аспекты.
Диоксид углерода применяется в производстве аспирина, свинцовых белил, мочевины, перборатов, химически чистых карбонатов. Угольная кислота, образующаяся при растворении СО2 в воде, – недорогой реагент для нейтрализации щелочей. В литейном производстве при помощи диоксида углерода отверждают песочные формы благодаря взаимодействию CO2 с силикатом натрия, смешанным с песком. Это позволяет получать более качественные отливки. Огнеупорный кирпич, которым выложены печи для выплавки стали, стекла и алюминия, после обработки диоксидом углерода становится более прочным. СО2 используется также в городских системах умягчения воды с помощью натронной извести.
Создание повышенного давления.
СО2 применяют для опрессовки и проверки на течь различных емкостей, а также для калибровки манометров, клапанов, свечей зажигания. Им наполняют портативные контейнеры для накачивания спасательных поясов и надувных лодок. Смесь диоксида углерода и закиси азота долгое время применяли для создания давления в аэрозольных баллончиках. СО2 нагнетают под давлением в герметичные емкости с эфиром (в устройствах для быстрого запуска двигателей), растворителями, красками, инсектицидами для последующего распыления этих веществ.
Применение в медицине.
В небольших количествах СО2 добавляют к кислороду (для стимуляции дыхания) и при анестезии. В высоких концентрациях его применяют для гуманного умерщвления животных.

Диоксид углерода – химическое соединение, которое образуется при взаимодействии кислорода и углерода, данное вещество также называется углекислым газом, двуокисью углерода или угольным ангидридом.
Свойства диоксида углерода, получение
Как известно, углекислый газ содержится в атмосфере Земли, это соединение выделяется в воздух как результат процесса дыхания животных и человека. Растения поглощают двуокись углерода в процессе фотосинтеза, то есть в светлое время суток, а ночью также выделяют его. Кроме того, диоксид углерода содержится в минералах, и определенное его количество должно непременно присутствовать в клетках организма человека и животных, так как он, к примеру, поддерживает и регулирует тонус сосудов.
По своим физическим свойствам диоксид углерода представляет собой бесцветный газ, не наделенный запахом, но имеющий слегка кисловатый вкус. При сильном охлаждении он способен кристаллизоваться, превращаясь в так называемый «сухой лед», которому человечество нашло немало способов применения.
Химические свойства диоксида углерода следующие:
- он прекрасно растворяется в воде, образуя при этом угольную кислоту;
- при взаимодействии со щелочами углекислый газ образует карбонаты и гидрокарбонаты;
- вступает в реакции нуклеофильного присоединения и электрофильного замещения;
- не поддерживает горения, в нем могут гореть лишь некоторые активные металлы (например, магний).
В природе углекислый газ существует как результат окислительных реакций в живых организмах и в минералах. В промышленных масштабах диоксид углерода получают одним из нескольких способов:
- Углекислый газ синтезируется как побочный продукт химических процессов (например, при разложении природных карбонов) или производства алкогольных напитков;
- Диоксид углерода получают с помощью абсорбирования дымовых газов карбонатом калия или моноэтаноламином;
- Существуют специальные установки по разделению воздуха в качестве побочного продукта во время производства кислорода, азота и аргона;
- Небольшое количество диоксида углерода можно получить в лабораторных условиях как результат взаимодействия карбонатов или гидрокарбонатов с кислотами;
- Для получения углекислого газа для приготовления напитков зачастую используется реакция соды и лимонной кислоты – именно так появились первые газированные напитки, первенство приготовления которых принадлежит аптекарям.
Как применяется диоксид углерода
К настоящему времени диоксид углерода активно используется во многих сферах и отраслях промышленности:
- Пищевая индустрия применяет углекислый газ в качестве консерванта или разрыхлителя, маркируемого как Е290. Эту добавку можно встретить в хлебобулочной продукции, безалкогольных и алкогольных напитках – именно благодаря угольному ангидриду существуют газировки и лимонады, пиво и шампанское. Кроме того, диоксид углерода используют в качестве защитного газа во время транспортировки и хранения некоторых пищевых продуктов;
- В системах пожаротушения и огнетушителях содержится жидкая углекислота;
- В процессе сварки проволокой в роли защитной среды выступает углекислый газ, правда, высокие температуры провоцируют диссоциацию соединения с выделением кислорода;
- Пневматическое оружие снабжается баллончиками с углекислотой, а авиамоделирование в качестве источника энергии для двигателей также применяет именно диоксид углерода;
- «Сухой лед» – кристаллическое состояние углекислого газа – используется для заморозки и хранения пищевых продуктов питания, в медицине для избавления от дефектов кожи (например, бородавок) и излишней пигментации, в качестве хладагента в лабораторных условиях и розничной торговле.
Как влияет диоксид углерода на организм человека

Как пищевая добавка углекислый газ признан «условно безопасным» и разрешен к использованию практически во всех странах мира, в том числе и в России. Тем не менее, по утверждению специалистов, чрезмерное употребление, например в составе газированных напитков, диоксида углерода, вред которого заключается в способности увеличивать всасываемость кишечника, может привести к следующим неприятным последствиям:
- быстрое опьянение в результате употребления газированных алкогольных напитков;
- вздутие живота и отрыжка;
- существуют данные, что сильногазированные напитки способны вымывать кальций из костей.
Медики настоятельно рекомендуют отказаться от употребления газированных напитков людям, страдающим заболеваниями желудочно-кишечного тракта.
Несмотря на то, что углекислый газ нетоксичен, повышение его концентрации во вдыхаемом воздухе может быть опасным. При незначительном увеличении уровня углекислого газа человек ощущает слабость и сонливость, если же наблюдаются такие симптомы как удушье, головокружение, расстройства слуха или даже потеря сознания – концентрация двуокиси углерода в воздухе чрезмерна. Вред диоксида углерода в этом случае будет заключаться в гиперкапнии (состоянии, когда концентрация углекислого газа в крови резко возрастает), что может привести даже к смерти от удушья.
В сварочном производстве используется термин «углекислый газ» см. ГОСТ 2601. В «Правилах устройства и безопасной эксплуатации сосудов, работающих под давлением» принят термин «углекислота», а в ГОСТ 8050 — термин «двуокись углерода».
Существует множество способов получения углекислого газа, основные из которых рассмотрены в статье Способы получения углекислого газа.
Плотность двуокиси углерода зависит от давления, температуры и агрегатного состояния, в котором она находится. При атмосферном давлении и температуре -78,5°С углекислый газ, минуя жидкое состояние, превращается в белую снегообразную массу «сухой лед».
Под давлением 528 кПа и при температуре -56,6°С углекислота может находиться во всех трех состояниях (так называемая тройная точка).
Двуокись углерода термически устойчива, диссоциирует на окись углерода и кислород только при температуре выше 2000°С.
Углекислый газ – это первый газ, который был описан как дискретное вещество. В семнадцатом веке, фламандский химик Ян Баптист ван Гельмонт (Jan Baptist van Helmont) заметил, что после сжигания угля в закрытом сосуде масса пепла была намного меньше массы сжигаемого угля. Он объяснял это тем, что уголь трансформируется в невидимую массу, которую он назвал «газ».
Свойства углекислого газа были изучены намного позже в 1750г. шотландским физиком Джозефом Блэком (Joseph Black).
Он обнаружил, что известняк (карбонат кальция CaCO3) при нагреве или взаимодействии с кислотами, выделяет газ, который он назвал «связанный воздух». Оказалось, что «связанный воздух» плотнее воздуха и не поддерживает горение.
Пропуская «связанный воздух» т.е. углекислый газ CO2 через водный раствор извести Ca(OH)2 на дно осаждается карбонат кальция CaCO3. Джозеф Блэк использовал этот опыт для доказательства того, что углекислый газ выделяется в результате дыхания животных.
Жидкая двуокись углерода бесцветная жидкость без запаха, плотность которой сильно изменяется с изменением температуры. Она существует при комнатной температуре лишь при давлении более 5,85 МПа. Плотность жидкой углекислоты 0,771 г/см 3 (20°С). При температуре ниже +11°С она тяжелее воды, а выше +11°С — легче.
Удельная масса жидкой двуокиси углерода значительно изменяется с температурой, поэтому количество углекислоты определяют и продают по массе. Растворимость воды в жидкой двуокиси углерода в интервале температур 5,8-22,9°С не более 0,05%.
Жидкая двуокись углерода превращается в газ при подводе к ней теплоты. При нормальных условиях (20°С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. При чрезмерно быстром отборе газа, понижении давления в баллоне и недостаточном подводе теплоты углекислота охлаждается, скорость ее испарения снижается и при достижении «тройной точки» она превращается в сухой лед, который забивает отверстие в понижающем редукторе, и дальнейший отбор газа прекращается. При нагреве сухой лед непосредственно превращается в углекислый газ, минуя жидкое состояние. Для испарения сухого льда необходимо подвести значительно больше теплоты, чем для испарения жидкой двуокиси углерода — поэтому если в баллоне образовался сухой лед, то испаряется он медленно.
Впервые жидкую двуокись углерода получили в 1823 г. Гемфри Дэви (Humphry Davy) и Майкл Фарадей (Michael Faraday).
Твердая двуокись углерода «сухой лед», по внешнему виду напоминает снег и лед. Содержание углекислого газа, получаемого из брикета сухого льда, высокое — 99,93-99,99%. Содержание влаги в пределах 0,06-0,13%. Сухой лед, находясь на открытом воздухе, интенсивно испаряется, поэтому для его хранения и транспортировки используют контейнеры. Получение углекислого газа из сухого льда производится в специальных испарителях. Твердая двуокись углерода (сухой лед), поставляемая по ГОСТ 12162.
Двуокись углерода чаще всего применяют:
- для создания защитной среды при сварке металлов;
- в производстве газированных напитков;
- охлаждение, замораживание и хранения пищевых продуктов;
- для систем пожаротушения;
- для чистки поверхностей сухим льдом.
Плотность углекислого газа достаточно высока, что позволяет обеспечивать защиту реакционного пространства дуги от соприкосновения с газами воздуха и предупреждает азотирование металла шва при относительно небольших расходах углекислоты в струе. Углекислый газ является активным газом, в процессе сварки он взаимодействует с металлом шва и оказывает на металл сварочной ванны окисляющее, а также науглероживающее действие.
Ранее препятствием для применения углекислоты в качестве защитной среды являлись поры в швах. Поры вызывались кипением затвердевающего металла сварочной ванны от выделения оксиси углерода (СО) вследствие недостаточной его раскисленности.
При высоких температурах углекислый газ диссоциирует с образованием весьма активного свободного, одноатомного кислорода:
Окисление металла шва выделяющимся при сварке из углекислого газа свободным кислородом нейтрализуется содержанием дополнительного количества легирующих элементов с большим сродством к кислороду, чаще всего кремнием и марганцем (сверх того количества, которое требуется для легирования металла шва) или вводимыми в зону сварки флюсами (сварка порошковой проволокой).
Как двуокись, так и окись углерода практически не растворимы в твердом и расплавленном металле. Свободный активный кислород окисляет элементы, присутствующие в сварочной ванне, в зависимости от их сродства к кислороду и концентрации по уравнению:
где Мэ — металл (марганец, алюминий или др.).
Кроме того, и сам углекислый газ реагирует с этими элементами.
В результате этих реакций при сварке в углекислоте наблюдается значительное выгорание алюминия, титана и циркония, и менее интенсивное — кремния, марганца, хрома, ванадия и др.
Особенно энергично окисление примесей происходит при полуавтоматической сварке. Это связано с тем, что при сварке плавящимся электродом взаимодействие расплавленного металла с газом происходит при пребывании капли на конце электрода и в сварочной ванне, а при сварке неплавящимся электродом — только в ванне. Как известно, взаимодействие газа с металлом в дуговом промежутке происходит значительно интенсивнее вследствие высокой температуры и большей поверхности контактирования металла с газом.
Ввиду химической активности углекислого газа по отношению к вольфраму сварку в этом газе ведут только плавящимся электродом.
Двуокись углерода нетоксична и невзрывоопасна. При концентрациях более 5% (92 г/м 3 ) углекислый газ оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья. Помещения, где производится сварка с использованием углекислоты, должны быть оборудованы общеобменной приточно-вытяжной вентиляцией. Предельно допустимая концентрация углекислого газа в воздухе рабочей зоны 9,2 г/м 3 (0,5%).
Углекислый газ поставляется по ГОСТ 8050. Для получения качественных швов используют газообразную и сжиженную двуокись углерода высшего и первого сортов.
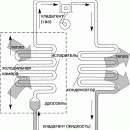
Углекислоту транспортируют и хранят в стальных баллонах по ГОСТ 949 или цистернах большой емкости в жидком состоянии с последующей газификацией на заводе, с централизованным снабжением сварочных постов через рампы. В стандартный баллон с водяной емкостью 40 л заливается 25 кг жидкой углекислоты, которая при нормальном давлении занимает 67,5% объема баллона и дает при испарении 12,5 м 3 углекислого газа. В верхней части баллона вместе с газообразной углекислотой скапливается воздух. Вода, как более тяжелая, чем жидкая двуокись углерода, собирается в нижней части баллона.
Для снижения влажности углекислого газа рекомендуется установить баллон вентилем вниз и после отстаивания в течение 10. 15 мин осторожно открыть вентиль и выпустить из баллона влагу. Перед сваркой необходимо из нормально установленного баллона выпустить небольшое количество газа, чтобы удалить попавший в баллон воздух. Часть влаги задерживается в углекислоте в виде водяных паров, ухудшая при сварке качество шва.
При выпуске газа из баллона вследствие эффекта дросселирования и поглощения теплоты при испарении жидкой двуокиси углерода газ значительно охлаждается. При интенсивном отборе газа возможна закупорка редуктора замерзшей влагой, содержащейся в углекислоте, а также сухим льдом. Во избежание этого при отборе углекислого газа перед редуктором устанавливают подогреватель газа. Окончательное удаление влаги после редуктора производится специальным осушителем, наполненным стеклянной ватой и хлористым кальцием, силикогелием, медным купоросом или другими поглотителями влаги
Баллон с двуокисью углерода окрашен в черный цвет, с надписью желтыми буквами «УГЛЕКИСЛОТА».



Отправить ответ