Формула простого вещества аргона
Содержание:
История открытия:
Первый вклад в открытие аргона внес английский физик и химик Генри Кавендиш. Изучая в 1785 году окисление атмосферного азота кислородом под действием электрического разряда, он обнаружил, что остается небольшой объем газа, не подвергающегося окислению. Однако он не нашел объяснения этому факту. В 1892 году английский физик Дж. Рэлей обнаружил небольшое (всего на 0,13%) превышение плотности азота, выделяемого из воздуха, над плотностью азота, получаемого химическим путем. Английский физик У. Рамзаем предположил, что причиной этого может быть примесь еще неизвестного более тяжелого газа и предложил выделить его. Ему и Дж. Рэлею в 1894 году удалось выделить этот газ и спектральным анализом доказать, что это новый химический элемент. Дальнейшие исследования показали полную химическую инертность этого вещества. Благодаря своей химической инертности (а это был первый из открытых инертных газов), новый элемент и получил свое название Аргон (греч. аrgos — неактивный, ленивый).
Нахождение в природе и получение:
В атмосферном воздухе содержится 0,93% аргона по объему (9,34 л в 1м 3 ), его запасы в атмосфере оцениваются в 4·10 14 т. Среди других изотопов преобладает aргон-40, постоянно образующийся в ходе ядерной реакции ("электронный захват") из природного изотопа калия: + ne
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре -185,9°C аргон конденсируется, при -189,4°С — кристаллизуется.
Физические свойства:
Бесцветный, без запаха газ. Температура кипения аргона (при нормальном давлении) -185,9°C, температура плавления -189,4°C. Плотность при нормальных условиях 1,784 кг/м3. В 100 мл воды при 20°C растворяется около 3,3 мл аргона. в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде. При пропускании электрического разряда через стеклянную трубку, заполненную аргоном, наблюдается сине-голубое свечение.
Химические свойства:
Аргон химически инертен, при обычных условиях химических соединений не образует. Однако со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода "гость", находится в полости, образованной в кристаллической решетке молекулами вещества-хозяина.
При сверхнизких температурах спектральными методами зафиксировано образование некоторых чрезвычайно неустойчивых молекул, содержащих аргон.
Установлено существование так называемых эксимерных молекул, содержащих аргон. На переходах этих молекул из метастабильного состояния в несвязанное генерируется лазерное излучение.
Важнейшие соединения:
Клатрат Ar*6H2O — соединение включения, температура разложения Аr·6Н2О при 101325 Па 42,0°С.
Гидрофторид аргона HArF — первое открытое, и пока единственное известное на 2013 г. химическое соединение аргона с электронейтральной молекулой. Получен при УФ-облучении смеси аргона и фтороводорода при 8K. Нестоек и распадается уже при 17 К на фтороводород и аргон.
CU(Ar)O — образование такого соединение при 3 К предполагается на основании спектральных данных. В этой молекуле уран должен быть связан с тремя другими атомами — углеродом, аргоном и кислородом.
Применение:
Аргон широко используют для создания инертной и защитной атмосферы, прежде всего при термической обработке легко окисляющихся металлов (аргоновая плавка, аргоновая сварка и другие). В атмосфере аргона получают кристаллы полупроводников и многие другие сверхчистые материалы. Аргоном часто заполняют электрические лампочки (для замедления испарения вольфрама со спирали). Это же его свойство используется в аргоновой сварке, которая позволяет соединять алюминиевые и дюралевые детали.
Аргон (в смеси с неоном, парами ртути) применяют для наполнения газоразрядных трубок (сине-голубое свечение), что используется в светящейся рекламе. Также аргон используется в аргоновых лазерах.
В геохронологии по определению соотношения изотопов 40 Ar/ 40 К устанавливают возраст минералов.
Мавлянова Н.Х., Жудин С.М.
ТюмГУ, 501 группа, 2013 г.
Химическая формула аргона
Химическое обозначение аргона – Ar от латинского слова «argon». Этот химический элемент расположен в третьем периоде в VIIIA группе Периодической таблицы Д.И. Менделеева. Относится к семейству инертных (благородных) газов. Относительная атомная масса аргона равна 39,948 а.е.м.
Электронная формула аргона
В ядре атома аргона содержится 18 протонов и 22 нейтрона (массовое число равно 40). В атоме аргона есть три энергетических уровня, на которых находится 18 электронов (рис. 1).
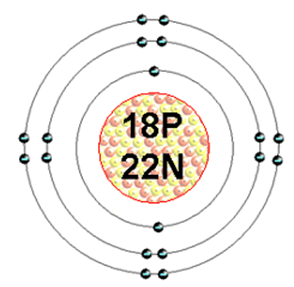
Рис. 1. Строение атома аргона.
Электронная формула атома аргона в основном состоянии выглядит следующим образом:
Примеры решения задач
| Задание | Рассчитайте относительную плотность по воздуху аргона. |
| Решение | Известно, что плотность какого-либо газа по воздуху рассчитывается как отношение молярной масса этого газа к молярной массе воздуха (29 г/моль): |
Молярная масса аргона равна 40 г/моль. Тогда его плотность по воздуху будет равна:
Dair (Ar) = 40 / 29 = 1,3793.
| Задание | Вычислите энергию ионизации для иона аргона Ar(1s 2 2s 2 2p 6 3s 2 3p 4 ). |
| Решение | Рассчитаем энергию ионизации иона аргона Ar(1s 2 2s 2 2p 6 3s 2 3p 4 ): |
ЕИ = R × z 2 / n 2 ,
где R – константа Ридберга равная 13,6 эВ; z–заряд атома, n – число электронов в атоме.
Порядковый номер аргона равен 18-ти, значит заряд атома аргона (+18). Количество электронов в данном ионе равно 16-ти.
Аргон — 18 элемент таблицы Менделеева
Аргон (лат. Argon), Ar, химический элемент VIII группы периодической системы, атомный номер 18, атомная масса 39,948, относится к инертным, или благородным, газам. Природный аргон состоит из трех стабильных нуклидов: 36Ar (0,337%), 38Ar (0,063%) и 40Ar (99,600%).
Радиус нейтрального атома аргона 0,192 нм. Электронная конфигурация нейтрального невозбужденного атома 1s22s2p63s2p6. Энергии последовательной ионизации нейтрального атома равны, соответственно, 15,759; 27,63; 40,91; 59,8 и 75 эВ. Простое вещество аргон — газ без запаха, цвета и вкуса.
Название: от греческого "argos" (недеятельный).
Физические свойства: аргон — одноатомный газ с температурой кипения (при нормальном давлении) –185,9°C (немного ниже, чем у кислорода, но немного выше, чем у азота), температура плавления –189,3°C. Критическая температура –122,43°C, критическое давление 4,86 МПа. Плотность при нормальных условиях 1,7839 кг/м3.
В 100 мл воды при 20°C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде.
Как уже говорилось, химических соединений не образует. Однако со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристалической решетке молекулами вещества-хозяина.



Отправить ответ