Из чего выплавляют алюминий
Содержание:
АЛЮМИНИЕВАЯ ПРОМЫШЛЕННОСТЬ. В 1854 А.Девиль изобрел первый практический способ промышленного производства алюминия. Рост производства был особенно быстрым во время и после Второй мировой войны. Производство первичного алюминия (без учета производства Советского Союза) составляло только 620 тыс. т в 1939, но возросло до1,9 млн. т в 1943. К 1956 во всем мире производилось 3,4 млн. т первичного алюминия; в 1965 мировое производство алюминия составило 5,4 млн. т, в 1980 – 16,1 млн. т, в 1990 – 18 млн. т.

Производство алюминия включает три основные стадии: добыча и обогащение руды; получение из руды чистой окиси алюминия (глинозема); восстановление алюминия из окиси путем электролиза.
Добыча и обогащение руды.
Основная алюминиевая руда – бокситы – добывается главным образом в карьерах; крупнейшими производителями бокситов являются Австралия, Гвинея, Ямайка и Бразилия. Обычно слой руды взрывается для образования рабочей площадки на глубине до 20 м, а потом выбирается. Куски руды дробятся и сортируются с помощью грохотов и классификаторов. Дробленая руда далее обогащается, а пустая порода (хвосты) выбрасывается. На этой стадии процесса экономически выгодно использовать методы промывки и грохочения, использующие разность плотностей руды и пустой породы для отделения их друг от друга. Менее плотная пустая порода уносится промывочной водой, а концентрат оседает на дно обогатительной установки. См. также РУДЫ ОБОГАЩЕНИЕ.
Процесс Байера.

Процесс получения чистой окиси алюминия включает нагревание боксита с едким натром, фильтрование, осаждение гидроокиси алюминия и ее прокаливание для выделения чистого глинозема. На практике руда смешивается с нужным количеством горячего едкого натра в автоклаве из низкоуглеродистой стали, и смесь прокачивается через ряд стальных сосудов с паровой рубашкой. В сосудах поддерживается давление пара 1,4–3,5 МПа в течение времени от 40 мин до нескольких часов, пока не завершится переход окиси алюминия из боксита в раствор алюмината натрия в перегретой жидкости. После охлаждения твердый осадок отделяется от жидкости. Жидкость фильтруется; в результате получается пересыщенный чистый раствор алюмината. Этот раствор метастабилен: алюминат-ион разлагается с образованием гидроокиси алюминия. Добавление в раствор кристаллической гидроокиси алюминия, остающейся от предыдущего цикла, ускоряет разложение. Сухие кристаллы гидроокиси алюминия затем прокаливаются для отделения воды. Получающийся безводный глинозем пригоден для использования в процессе Холла – Эру. По экономическим соображениям в промышленности эти процессы стремятся делать по возможности непрерывными.
Электролиз Холла – Эру.
Заключительная стадия производства алюминия включает его электролитическое восстановление из чистой окиси алюминия, полученной в процессе Байера. Этот способ извлечения алюминия основывается на том (открытом Холлом и Эру) факте, что когда глинозем растворяется в расплавленном криолите, при электролизе раствора выделяется алюминий. Типичный электролизер Холла – Эру представляет собой ванну с расплавленным криолитом 3NaF Ч AlF3 (Na3AlF6) – двойным фторидом натрия и алюминия, в котором растворено 3–5% глинозема, – плавающим на подушке из расплавленного алюминия. Стальные шины, проходящие через подину из углеродистых плит, используются для подачи напряжения на катод, а подвешенные угольные бруски, погруженные в расплавленный криолит, служат анодами. Рабочая температура процесса близка к 950 ° С, что значительно выше температуры плавления алюминия. Температура в электролизной ванне регулируется изменением зазора между анодами и катодным металлоприемником, на который осаждается расплавленный алюминий. Для поддержания оптимальной температуры и концентрации глинозема в современных электролизерах применяются сложные системы управления. На производство алюминия расходуется очень много электроэнергии, поэтому энергетический КПД процесса – главная проблема в алюминиевой промышленности. Электродные реакции представляют собой восстановление алюминия из его окиси и окисление углерода до его окиси и двуокиси на анодах. Одна печь дает до 2,2 т алюминия в сутки. Металл сливается раз в сутки (или реже), потом флюсуется и дегазируется в отражательной копильной печи и разливается по формам.


Возобновляемые электроды Содерберга.
В электролизере Холла – Эру угольные аноды расходуются со скоростью 2,5 см/сут, так что часто требуется установка новых анодов. Чтобы исключить частое вмешательство человека в производство, был разработан процесс с использованием возобновляемого электрода Содерберга. Анод Содерберга непрерывно образуется и спекается в восстановительной камере из пасты – смеси 70% молотого кокса и 30% смоляной связки. Эта смесь набивается в прямоугольную оболочку из листовой стали, открытую с обоих концов и расположенную вертикально над ванной с расплавом внутри печи. По мере расходования анода в верхнее отверстие оболочки добавляется паста. Когда коксосмоляная смесь опускается вниз и нагревается, она спекается в твердый углеродистый брусок прежде, чем достигает рабочей зоны.
Потребление алюминия.
Около 28% производимого алюминия идет на изготовление банок для напитков, пищевой тары и всевозможных упаковок. Еще 17% используется в транспортных средствах, включая самолеты, военную технику, железнодорожные пассажирские вагоны и автомобили. Около 16% применяется в конструкциях зданий. Примерно 8% используется в высоковольтных линиях электропередачи и других электрических устройствах, 7% – в таких потребительских товарах, как холодильники, кондиционеры воздуха, стиральные машины и мебель. На нужды машиностроения и промышленное оборудование расходуется 6%. Остающаяся часть потребляемого алюминия используется в производстве телевизионных антенн, пигментов и красок, космических кораблей и судов. См. также ХОЛЛ, ЧАРЛЗ МАРТИН.
Сандлер Р.А., Ратнер А.Х. Электрометаллургия алюминия и магния. Л., 1983
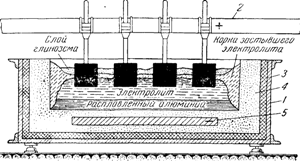
Рис. 151. Схема ванны для получения алюминия: 1 — корпус ванны; 2 — анодная шина; 3 — тепловая изоляция; 4 — угольная набивка; 5 — катодная шина
Ат. вес 26,98. Алюминий является самым распространенным металлом в природе. Он входит в состав глин, полевых шпатов, слюд и многих других минералов. Общее содержание алюминия в земной коре составляет 7,45 весовых процента. Основным сырьем для производства алюминия служат бокситы. Это сложная горная норода, содержащая глинозем (Аl2O3). К важнейшим алюминиевым рудам относятся также алунит K2SO4 • Al2 (SO4)3 • 2Аl2O3 • 6Н2O и нефелин Na2O • Al2O3 • 2SiO2.
СНГ располагает огромными запасами алюминиевых руд. Кроме бокситов, мощные месторождения которых имеются у нас на Урале, в Башкирской АССР, в Казахстане и других местах, богатейшим источником алюминия является нефелин, залегающий совместно с апатитом в Хибинах. Значительные залежи алюминиевого сырья имеются в Западной и Восточной Сибири.
Несмотря на широкое распространение в природе, алюминий до конца прошлого столетия принадлежал к числу редких металлов. Впервые он был получен Велером в 1827 г. действием металлического калия на хлористый алюминий. Затем до конца 80-х годов прошлого столетия алюминий получали путем выделения металлическим натрием из расплавленной двойной соли АlС3 • NaCl, что обходилось, конечно, очень дорого. В 50-х годах прошлого столетия 1 кг алюминия стоил еще около 500 руб.
С открытием электролитического способа получения алюминия (1886 г.) .и применением этого способа в заводском масштабе цена на алюминий стала быстро падать: перед мировой войной 1914—1918 гг. 1 кг алюминия стоил уже около 1 руб. В настоящее время алюминий получается в громадных количествах электролизом окиси алюминия, растворенной в расплавленном криолите.
На рис. 151 схематично изображена установка, служащая для получения алюминия. Она состоит из железного ящика (ванны), выложенного изнутри графитом или плитами из спрессованного угля, которые являются катодом при электролизе. Анодом служат несколько угольных пластин, соединенных общей оправой. Ящик наполняют смесью чистой окиси алюминия и криолита. Прибавление криолита необходимо для понижения температуры плавления, так как окись алюминия очень тугоплавка. При включении тока криолит плавится и растворяет в себе окись алюминия, которая и подвергается электролизу. Процесс ведется при температуре около 1000°, силе тока около 35 000 ампер и сред нем напряжении 4—5 вольт. На катоде выделяется алюминий, а на аноде кислород. Выделяющийся алюминий собирается на дне ванны, откуда его время от времени выпускают. По мере выделения алюминия в расплав добавляют новые порции окиси алюминия.
Месторождения криолита, этого очень важного для алюминиевой промышленности минерала, встречаются очень редко. Большие количества его имеются только в Гренландии. Поэтому обычно криолит получают искусственным путем — взаимодействием гидрата окиси алюминия с плавиковой кислотой и последующей нейтрализацией кислого раствора содой.
Чистую окись алюминия получают переработкой природного боксита. Необходимость применения чистой окиси алюминия вызывается тем, что очистка выплавленного алюминия весьма трудна; поэтому для получения чистого металла предпочитают очищать исходные материалы.
Интересны темпы роста алюминиевой промышленности. Мировая добыча алюминия, которая в 1900 г. составляла всего 10 тыс. т. в 1938 г. достигла 567 тыс. т, а в период второй мировой войны только в капиталистических странах производилось около 1 ;млн. т алюминия в год. Бывший еще недавно очень редким, алюминий по масштабам производства и потребления занял в настоящее время среди металлов одно из первых мест. В 1957 г. выплавка алюминия в капиталистических странах составила 2,7 млн. т.
В дореволюционной России алюминий не производился, и в годы первой мировой войны этот металл ввозился из других стран. Так, в 1915 г. было ввезено около 5 тыс. т алюминия.
Первый алюминиевый завод в СНГ (Волховский) был пущен в 1932 г. Через два года после этого вступил в строй второй завод (Днепровский), а уже в 1935 г. наша страна заняла по размерам производства алюминия третье место в мире. В последующие годы алюминиевая промышленность продолжала бурно развиваться. В 1955 г. выплавка алюминия возросла по сравнению с выплавкой 1950 г. в 2,8 раза, а в 1965 г. производство намечено увеличить в 2,8—3 раза по сравнению с 1958 г.
Первое время после открытия электролитического способа получения алюминия производство его опиралось исключительно на данные практики. Научные основы этого процесса были со-зданы лишь в начале 10-х годов нынешнего столетия. Большую роль в развитии теории электрометаллургии алюминия сыграли работы П. П. Федотьева и его учеников.
Алюминий представляет собой серебристо-белый легкий металл уд. веса 2,7, плавящийся при 660,1°. Он обладает большой тягучестью и сопротивлением разрыву, легко вытягивается в проволоку и прокатывается в тонкие листы.
При обыкновенной температуре алюминий не изменяется на воздухе, но лишь потому, что быстро покрывается тонким плотным слоем окиси, предохраняющим металл от дальнейшего окис ления. Уничтожение этого слоя, например путем амальгамирования алюминия, вызывает быстрое окисление металла, сопровождающееся довольно сильным разогреванием .
Нормальный потенциал алюминия равен — 1,66 вольта. Несмотря на это, алюминий вследствие образования на его поверхности плотного, чрезвычайно трудно растворимого слоя гидроокиси алюминия не вытесняет водород из воды . Амальгамированный алюминий энергично взаимодействует с водой с выделением водорода.
Разбавленные соляная и серная кислоты легко растворяют алюминий, особенно при нагревании. Так же легко растворяется алюминий и в щелочах с образованием алюминатов — соединений, аналогичных цинкатам, содержащих анион [Аl(ОН)4] — Напротив, холодная азотная кислота не только не растворяет алюминий, но делает его «пассивным», после чего он не растворяется и в разбавленных серной и соляной кислотах.
Если порошок алюминия (или тонкую алюминиевую фольгу) сильно нагреть, то он воспламеняется и сгорает ослепительным белым пламенем, образуя окись алюминия. Горение происходит чрезвычайно быстро; например, тонкий листок алюминия сгорает в 0,01 сек.
Ввиду своей легкости и сравнительной устойчивости в отношении коррозии алюминий получил чрезвычайно щирокое применение. Главными потребителями его являются авиа- и автопромышленность, где алюминий применяется в виде различных легких сплавов. Прибавка небольших количеств других металлов, не изменяя сколько-нибудь значительно веса алюминия, очень повышает его прочность.
Наиболее важным из сплавов алюминия является дур ал коми н, содержащий около 95% алюминия, 4% меди, 0,5% магния и 0,5% марганца. Большое распространение получили также магналий (сплав,. содержащий до 12% магния) и силумин (сплав алюминия и кремния) В электротехнической промышленности алюминий постепенно вытесняет медь как материал для проводов. Хотя электропроводность алюминия составляет около 60% электропроводности меди, но это понижение компенсируется легкостью алюминия, позволяющей делать провода более толстыми: при одинаковой электропроводности алюминиевый провод весит вдвое меньше медного.
Очень важным является применение алюминия для так называемого алитирования, заключающегося в насыщении поверхности стальных или чугунных изделий алюминием с целью защиты основного материала от окисления при сильном нагревании.
Алитирование производится или путем погружения изделия в расплавленный алюминий или, чаще, путем нагревания изде лия в смеси порошкообразного алюминия с окисью алюминия. При нагревании алюминий проникает в поверхностный слой изделия, образуя с железом твердый раствор. Алитированные стальные изделия выдерживают нагревание на воздухе до 900°, не подвергаясь окислению.
Отметим еще применение алюминия для устройства простейших выпрямителей переменного тока. Выпрямитель составляется из алюминиевого и железного (или свинцового) электродов, погруженных в раствор соды. Такой прибор пропускает ток только в одном направлении, при котором алюминий является катодом. Если включить алюминиевый выпрямитель в цепь переменного тока, то получается пульсирующий ток постоянного направления.
В виде тонкого порошка алюминий применяется в качестве краски для покрытия железа, хорошо предохраняющей его от коррозии, в качестве литографской краски, а также для составления некоторых взрывчатых смесей типа аммоналов . Грубозернистый порошок алюминия применяется для восстановления многих металлов, , для осветительных ракет и для изготовления термита. Тонкая алюминиевая фольга служит для упаковки шоколада, конфет и других кондитерских изделий. Наконец, общеизвестно широкое применение алюминия для изготовления различных предметов домашнего обихода: кастрюль, ложек и т. п.
Алюминий образует только один окисел Al2O3 и во всех своих соединениях трехвалентен.
Окись алюминия Аl2O3, называемая также глиноземом, встречается в природе в кристаллическом виде, образуя минерал корунд. По твердости корунд занимает второе место после алмаза. Прозрачные кристаллы корунда, окрашенные в красный или синий цвет, представляют собой драгоценные камни — р у-бин и сапфир. В настоящее время рубины получают искусственно, сплавляя глинозем в’ электрической печи. Они идут не столько для украшений, сколько для технических целей, например: для изготовления деталей точных приборов, для камней в часах и т. п. Из непрозрачных кристаллов корунда, содержащих большое количество примесей, состоит обыкновенный наждак.
Гидрат окиси алюминия Аl(ОН)3 выпадает в виде студенистого осадка при действии щелочей на растворы алюминиевых солей и легко переходит в коллоидное состояние. При нагревании Аl(ОН)3 постепенно теряет воду, образуя более бедные водой гидраты, например:

Гидрат окиси алюминия—типичная амфотерная гидроокись. С кислотами она образует соли, содержащие гидратированный ион алюминия [Аl(Н2O)6] ••• со щелочами — соли, содержащие анион [Аl(ОН)4]’ и называемые алюмината ми (например, Na[Al(ОН)4]. Последние раньше рассматривались как соли мета-алюминиевой кислоты НАlO2. В соответствии с этим формула алюмината натрия изображалась следующим образом: NaAlO2.
Реакция образования алюмината может быть выражена уравнением:
Алюминаты получаются также при растворении металлического алюминия в щелочах:
Реакция протекает аналогично растворению цинка в щелочах.
Соли, содержащие ионы Аl ••• , в водных растворах сильно ги-ролизованы и показывают кислую реакцию:
Если раствор алюминиевой соли подвергнуть диализу, то благодаря постепенному удалению кислоты можно разложить всю соль. Выделяющийся гидрат окиси алюминия переходит при этом в коллоидный раствор.
Со слабыми кислотами гидрат окиси алюминия или образует основные соли или совсем не дает солей. Так, например, при действии раствора соды на раствор алюминиевой соли вместо карбоната алюминия получается гидрат окиси алюминия:
Течение реакции можно представить себе следующим образом. Вследствие гидролиза в водных растворах алюминиевых солей устанавливается равновесие:
В свою очередь в растворе соды по той же причине имеется равновесие:
При сливании растворов ионы Н • связываются с ионами ОН’ и НСО3‘ в молекулы воды и угольной кислоты. Молекулы же угольной кислоты разлагаются на воду и углекислый газ. Благодаря этому оба равновесия непрерывно смещаются вправо ,и в конце концов весь алюминий выпадает в осадок в виде Аl(ОН)3.
Из солей алюминия необходимо отметить следующие:
1. Хлорид алюминия, или хлористый алюминий, АlСl3. Безводный хлорид алюминия получается прямым действием хлора на алюминий. Он широко применяется в качестве катализатора при различных органических синтезах. В воде хлорид алюминия растворяется с выделением большого количества тепла. При выпаривании раствора происходит гидролиз, выделяется хлористый водород и получается гидрат окиси алюминия. Если выпаривание вести в присутствии избытка соляной кислоты, то можно получить кристаллы состава АlСl3 • 6Н2О.
2. Сульфат алюминия Al2(SO4)3 • 18Н2O получается при действии горячей серной кислоты на глинозем или на чистую глину (каолин). Применяется для очистки воды , а также при приготовлении некоторых сортов бумаги.
3. Алюминиевые квасцы KAl(SO4)2 • 12Н2O— наиболее важная в техническом отношении соль алюминия. Применяется в больших количествах для дубления кож и в красильном деле в качестве протравы для хлопчатобумажных тканей. В последнем случае действие ее основано на том, что образующийся вследствие гидролиза Аl(OН)3 отлагается в волокнах ткани в мелкодисперсном состоянии и, адсорбируя краситель, прочно удерживает его на волокне.
4. Ультрамарин представляет собой общеизвестную синюю краску, которая в виде порошка употребляется в качестве «синьки» для белья. По химическому составу — это продукт присоединения Na2S3 к алюмосиликату Na2Al 2Si2O3. Получается путем нагревания смеси каолина, серы и соды с небольшим количеством сахара.
Вы читаете, статья на тему Алюминий (Aluminium)
Алюминий впервые выделен в свободном виде в 1825 г. датским физиком Эрстедом. В настоящее время в промышленных масштабах алюминий получают электролитическим путем. Способ получения металлического алюминия электролизом глинозема, растворенного в криолите, запатентовали в 1886 г. независимо друг от друга Поль Эру во Франции и Чарльз Хол в США.
Производство алюминия развивалось с тех пор чрезвычайно быстрыми темпами, благодаря тому значению, которое приобрел алюминий в промышленности. До 1917 г. наша страна не имела собственного алюминиевого завода, хотя русские ученые внесли большой вклад в металлургию алюминия. В 1929 г. на ленинградском заводе «Красный выборжец» был получен алюминий на Волховской энергии и на отечественном сырье. В 1932 г. пущен в строй Волховский алюминиевый завод, а в 1933 г. — Днепровский алюминиевый завод. В дальнейшем были построены алюминиевые заводы в различных районах нашей страны.
Создание мощной энергетической базы позволило нашей стране быстро выйти на одно из первых мест по производству алюминия.
Свойства алюминия
В чистом виде алюминий — металл серебристого белого цвета. Одно из важных свойств алюминия — его малая плотность: в твердом состоянии (при 20° С) она равна 2,7 г/см 3 , а в жидком виде (при 900° С) — 2,32 г/см 3 . Температура плавления высокочистого алюминия (99,996%) равна 660,24° С, температура кипения — 2500° С. Важными свойствами алюминия, определяющими его применение во многих областях промышленности, являются его хорошая электропроводность и теплопроводность.
 Алюминий хорошо обрабатывается механически, обладает хорошей ковкостью, легко прокатывается в тончайший лист и проволоку. В химических реакциях алюминий амфотерен. Он растворяется в щелочах, соляной и серной кислотах, но стоек по отношению к концентрированной азотной и органическим кислотам. На внешней М-оболочке алюминия три валентных электрона, причем два — на 3s- орбите и один на 3p-орбите. Поэтому обычно в химических соединениях алюминий трехвалентен. Однако в ряде случаев алюминий может терять один p-электрон и проявлять себя одновалентным, образуя соединения низшей валентности.
Алюминий хорошо обрабатывается механически, обладает хорошей ковкостью, легко прокатывается в тончайший лист и проволоку. В химических реакциях алюминий амфотерен. Он растворяется в щелочах, соляной и серной кислотах, но стоек по отношению к концентрированной азотной и органическим кислотам. На внешней М-оболочке алюминия три валентных электрона, причем два — на 3s- орбите и один на 3p-орбите. Поэтому обычно в химических соединениях алюминий трехвалентен. Однако в ряде случаев алюминий может терять один p-электрон и проявлять себя одновалентным, образуя соединения низшей валентности.
Производство алюминия в настоящее время включает в себя две основные операции:
- получение безводной, свободной от сопутствующих алюминию примесей, окиси алюминия путем сложной химической переработки природных соединений (бокситов, глины, каолина);
- получение металлического алюминия методом электролиза глинозема, растворенного в криолите.
Алюминий обладает многими ценными свойствами: небольшой плотностью— около 2,7 г/см 3 , высокой теплопроводностью — около 300 Вт/(м • К) и высокой электропроводностью 13,8 • 10 7 Ом/м, хорошей пластичностью и достаточной механической прочностью.
Алюминий образует сплавы со многими элементами. В сплавах алюминий сохраняет свои свойства. В расплавленном состоянии алюминий жидкотекуч и хорошо заполняет формы, в твердом виде он хорошо деформируется и легко поддается резанию, пайке и сварке.
Сродство алюминия к кислороду очень большое. При его окислении выделяется большое количество тепла (
1670000 Дж/моль). Тонкоизмельченный алюминий при нагревании воспламеняется и сгорает на воздухе. Алюминий соединяется с кислородом воздуха и в атмосферных условиях. При этом алюминий покрывается тонкой (толщиной
0,0002 мм) плотной пленкой окиси алюминия, защищающей его от дальнейшего окисления; поэтому алюминий стоек против коррозии. Поверхность алюминия хорошо защищается от окисления этой пленкой и в расплавленном состоянии.
Сплавы алюминия
Из сплавов алюминия наибольшее значение имеют дюралюминий и силумины.
В состав дюралюминия, кроме алюминия, входят 3,4—4 % Cu, 0,5 % Mn и 0,5 % Mg, допускается не более 0,8 % Fe и 0,8 % Si. Дюралюминий хорошо деформируется и по своим механическим свойствам близок к некоторым сортам стали, хотя он в 2,7 раза легче стали (плотность дюралюминия 2,85 г/см 3 ).
Механические свойства этого сплава повышаются после термической обработки и деформации в холодном состоянии. Сопротивление на разрыв повышается со 147—216 МПа до 353— 412 МПа, а твердость по Бринелю с 490—588 до 880—980 МПа. При этом относительное удлинение сплава почти не изменяется и остается достаточно высоким (18—24 %).
Силумины — литейные сплавы алюминия с кремнием. Они обладают хорошими литейными качествами и механическими свойствами.
Алюминий и сплавы широко применяют во многих отраслях промышленности, в том числе в авиации, транспорте, металлургии, пищевой промышленности и др. Из алюминия и его сплавов изготовляют корпуса самолетов, моторы, блоки цилиндров, коробки передач, насосы и другие детали в авиационной, автомобильной и тракторной промышленности, сосуды для хранения химических продуктов. Алюминий широко применяют в быту, пищевой промышленности, в ядерной энергетике и электронике. Многие части искусственных спутников нашей планеты и космических кораблей изготовлены из алюминия и его сплавов.
Вследствие большого химического сродства алюминия к кислороду его применяют в металлургии как раскислитель, а также для получения при использовании так называемого алюминотермического процесса трудно восстанавливаемых металлов (кальция, лития и др.). По общему производству металла в мире алюминий занимает второе место после железа.
Сырые материалы для производства алюминия
Основным современным способом производства алюминия является электролитический способ, состоящий из двух стадий. Первая — это получение глинозема (Al2O3) из рудного сырья и вторая — получение жидкого алюминия из глинозема путем электролиза.
Руды алюминия
Вследствие высокой химической активности алюминий встречается в природе только в связанном виде: корунд Al2O3, гиббсит Al2O3 • ЗН2O, бемит Al2O3 • Н2O, кианит 3Al2O3 • 2SiO2, нефелин (Na, К)2O • Al2O3 • 2SiO2, каолинит Al2O3 • 2SiO2 • 2Н2О и другие. Основными используемыми в настоящее время алюминиевыми рудами являются бокситы, а также нефелины и алуниты.
Бокситы
Алюминий в бокситах находится главным образом в виде гидроксидов алюминия (гиббсита, бемита и др.), корунда и каолинита. Химический состав бокситов довольно сложен. Они часто содержат более 40 химических элементов. Содержание глинозема в них составляет 35—60 %, кремнезема 2—20 %, оксида Fe2O3 2—40 %, окиси титана 0,01—10 %. Важной характеристикой бокситов является отношение содержаний в них Al2O3 к SiO2 по массе — так называемый кремневый модуль.
Кремневый модуль бокситов, поступающих для получения глинозема, должен быть не ниже 2,6. Для бокситов среднего качества этот модуль составляет 5—7 при 46—48 %-ном содержании Al2O3, а модуль высококачественных — около 10 при 50 %-ном содержании Al2O3. Бокситы с более высоким содержанием Al2O3 (52 %) и модулем (10—12) идут для производства электрокорунда.
К числу крупных месторождений бокситов в нашей стране относится Тихвинское (Ленинградская область), Североуральское (Свердловская область), Южноуральское (Челябинская область), Тургайское и Краснооктябрьское (Кустанайская область).
Нефелины
Нефелины входят в состав нефелиновых сиенитов и уртитов. Большое месторождение уртитов находится на Кольском полуострове. Основные компоненты уртита — нефелин и апатит ЗСа3(РO4)2 • СаF2. Их подвергают флотационному обогащению с выделением нефелинового и апатитового концентратов. Апатитовый концентрат идет для приготовления фосфорных удобрений, а нефелиновый — для получения глинозема. Нефелиновый концентрат содержит, %: 20—30 Al2O3, 42—44 SiO2, 13-14 Na2O, 6-7 К2O, 3-4 Fe2O3 и 2-3 СаО.
Алуниты
Алуниты представляют собой основной сульфат алюминия и калия (или натрия) К2SO4 • Al2(SO4)3 • 4Al(ОН)3. Содержание Al2O3 в них невысокое (20—22 %), но в них находятся другие ценные составляющие: серный ангидрид SO3 (
20 %) и щелочь Na2O • К2O (4—5 %). Таким образом, они, так же как и нефелины, представляют собой комплексное сырье.
Другие сырые материалы
При производстве глинозема применяют щелочь NaОН, иногда известняк СаСО3, при электролизе глинозема криолит Na3AlF6 (3NaF•AlF3) и немного фтористого алюминия AlF3, а также СаF2 и MgF2.
Производство криолита
Криолит в естественном виде в природе встречается очень редко и его производят искусственно из концентрата плавикового шпата (СаF2). Процесс осуществляют в две стадии, первая — это получение плавиковой кислоты HF. Тонкоизмельченный СаF2 смешивают с серной кислотой в трубчатых вращающихся печах при 200 °С. В печи протекает реакция: СаF2+Н2SO4=2НF+СаSO4. Поскольку в плавиковом шпате содержится в качестве примеси SiO2, образуется также немного летучей кремнефтористой кислоты Н2SiF6. Газообразные НF и Н2SiF6 после их очистки от примесей поглощаются в вертикальных башнях водой, в результате получают раствор плавиковой кислоты с кремнефтористой. Его очищают от Н2SiF6, добавляя немного соды: Н2SiF6+Na2CO3=Na2SiF+Н2O+СO2. Кремнефтористый натрий выпадает в осадок и получается очищенная плавиковая кислота. Вторая стадия — получение криолита. В раствор плавиковой кислоты добавляют Аl(ОН)3 и соду и проводят так называемый процесс варки криолита, в течение которого протекают следующие реакции:
Криолит выпадает в осадок, его отфильтровывают и просушивают при температуре 130—150 °С.
Фтористый алюминий получают схожим способом, добавляя к плавиковой кислоте до полной ее нейтрализации гидроксид алюминия: 3HF + Al(OH)3 = AlF3 + 3H2O.
Рафинирование алюминия
Алюминий, извлекаемый из электролизных ванн, называют алюминием-сырцом. Он содержит металлические (Fe, Si, Cu, Zn и др.) и неметаллические примеси, а также газы (водород, кислород, азот, оксиды углерода, сернистый газ). Неметаллические примеси — это механически увлеченные частицы глинозема, электролит, частицы футеровки и др.
Для очистки от механически захваченных примесей, растворенных газов, а также от Na, Са и Мg алюминий подвергают хлорированию. Для этого в вакуум-ковш вводят трубку, через которую в течение 10—15 мин подают газообразный хлор, причем для увеличения поверхности соприкосновения газа с металлом на конце трубки крепят пористые керамические пробки, обеспечивающие дробление струи газа на мелкие пузырьки. Хлор энергично реагирует с алюминием, образуя хлористый алюминий AlCl3. Пары хлористого алюминия поднимаются через слой металла и вместе с ними всплывают взвешенные неметаллические примеси, часть газов и образующиеся хлориды Na, Са, Мg и Н2.
Далее алюминий заливают в электрические печи-миксеры или в отражательные печи, где в течение 30—45 мин происходит его остаивание. Цель этой операции — дополнительное очищение от неметаллических и газовых включений и усреднение состава путем смешения алюминия из разных ванн. Затем алюминий разливают либо в чушки на конвейерных разливочных машинах, либо на установках непрерывного литья в слитки для прокатки или волочения. Таким образом получают алюминий чистотой не менее 99,8 % Аl.
Алюминий более высокой степени чистоты в промышленном масштабе получают путем последующего электролитического рафинирования жидкого алюминия по так называемому трехслойному методу. Электролизная ванна имеет стенки из магнезита, угольную подину (анод) и подвешенные сверху графитированные катоды. На подину через боковое отверстие порциями заливают исходный алюминий, поддерживая здесь анодный слой определенной толщины; выше него располагается слой электролита из фтористых и хлористых солей, а над электролитом — слой очищенного алюминия, который легче электролита; в этот слой погружены концы катодов.
Для того, чтобы рафинируемый алюминий находился внизу, его утяжеляют, формируя в анодном слое сплав алюминия с медью (в слое растворяют 30—40 % Сu). В процессе электролиза ионы Al 3+ перемещаются из анодного слоя через слой электролита в катодный слой и здесь разряжаются. Накапливающийся на поверхности ванны чистый катодный металл вычерпывают и разливают в слитки. Этим способом получают алюминий чистотой 99,95—99,99%. Расход электроэнергии равен
18000 кВт • ч на 1 т алюминия. Более чистый алюминий получают методом зонной плавки или дистилляцией через субгалогениды.



Отправить ответ