Карбиды получение и химические свойства
Содержание:
Карби́ды — соединения металлов и неметаллов с углеродом. Традиционно к карбидам относят соединения, где углерод имеет бо́льшую электроотрицательность, чем второй элемент (таким образом из карбидов исключаются такие соединения углерода, как оксиды, галогениды и т. п.)
Содержание
Свойства [ править | править код ]
Карбиды — тугоплавкие твёрдые вещества. Они нелетучи и не растворимы ни в одном из известных растворителей. Карбиды бора и кремния (В4С и SiC), титана, вольфрама, циркония (TiC, WC и ZrC соответственно) обладают высокой твёрдостью, жаростойкостью, химической инертностью.
Применение [ править | править код ]
Карбиды применяют в производстве чугунов и сталей, керамики, различных сплавов, как абразивные и шлифующие материалы, как восстановители, раскислители, катализаторы и др. WC и TiC входят в состав твёрдых сплавов, из которых готовят режущий инструмент; карбид кальция СаС2 используют для получения ацетилена; из карбида кремния SiC (карборунд) готовят шлифовальные круги и другие абразивы; карбид железа Fe3C (цементит) входит в состав чугунов и сталей, из карбида вольфрама и карбида хрома производят порошки, используемые при газотермическом напылении.
Разновидности [ править | править код ]
Карбиды могут быть образованы разными органическими соединениями, а могут не иметь аналогов среди органических веществ. Есть, например, ацетилениды, метаниды и другие.
Карбиды подразделяются на следующие виды:
Солеобразные карбиды обычно разлагаются водой и кислотами с выделением углеводородов (некоторые очень бурно, например, карбиды натрия, калия, цезия). Ковалентные карбиды обычно химически инертны. Металлоподобные карбиды имеют промежуточную химическую активность.
Метаниды [ править | править код ]
Метаниды — ионные карбиды, являющиеся производными метана [1] . В воде или разбавленных кислотах разлагаются с образованием метана [1] [2] . Примерами метанидов являются карбид алюминия (Al4C3), карбид бериллия (Be2C) [1] и карбид магния (Mg2C) [3] . В чистом виде бесцветны и прозрачны [2] .
Ацетилениды [ править | править код ]
Ацетилениды — ионные карбиды, являющиеся производными ацетилена (этина). Активно гидролизуются с образованием ацетилена, наибольшее практическое значение имеет карбид (ацетиленид) кальция CaC2.
КАРБИДЫ (от латинского carbo – уголь) – соединения углерода с металлами, а также с бором и кремнием. Эти соединения обладают удивительным разнообразием физических и химических свойств. Так, карбид золота Au2C2 взрывается уже при попытке пересыпать его с листочка фильтровальной бумаги, на котором он был высушен. С другой стороны, карбиды некоторых элементов (например, бора и тантала) не разлагаются даже при температуре белого каления и настолько химически инертны, что на них не действует царская водка, а по твердости они приближаются к алмазу!
Впервые необычное соединение металла с углеродом (К2С2) получил в 1809 знаменитый английский химик Гемфри Дэви. В 1863 французский химик Марселен Бертло изучил свойства другого карбида – очень неустойчивого и легко взрывающегося карбида одновалентной меди Cu2C2. В 1878 немецкий металлург Ф.Мюллер, растворив образцы стали в разбавленной серной кислоте, выделил карбид железа Fe3C. Но только в конце 19 в. французский химик Анри Муассан, прославившийся получением фтора, синтезировал многие из этих необычных соединений и изучил их свойства. Он получал карбиды, нагревая до очень высокой температуры смеси древесного угля с разными металлами, их оксидами или карбонатами. Для этого он использовал жар вольтовой дуги в электрической печи собственной конструкции.
Карбиды, как оказалось, можно получить не только в лаборатории. Еще до работ Муассана австрийский ученый Э.Вайнсхенк в 1889 открыл в метеоритах минерал когенит, представляющий собой смешанный карбид железа, кобальта и никеля состава (FeNiCo)3C. А сам Муассан в 1904 обнаружил в метеорите, привезенном из каньона Диабло в штате Аризона, темно-зеленый минерал, представляющий собой карбид кремния SiC. Этот минерал в честь ученого назвали муассанитом.
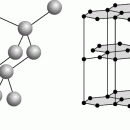
Раньше карбиды классифицировали по их устойчивости к действию воды и кислот, а также по тому, какие газы выделяются при их разложении. Современная классификация учитывает тип химической связи между атомами в карбидах – именно от этого зависят в основном физические и химические свойства. В соответствии с этой классификацией, карбиды можно разделить на три группы, которые довольно сильно отличаются по своим свойствам.
К первой группе относятся так называемые солеобразные карбиды с ионной связью. Эти карбиды образуют щелочные и щелочноземельные металлы, алюминий, редкоземельные элементы, а также актиноиды. Их состав иногда соответствует типичным валентностям металлов (Al4C3), а иногда – нет (Ве2С). Многие ионные карбиды можно получить непосредственно из элементов (Са + 2С ® СаС2) или восстановлением оксидов углеродом (СаО + 3С ® СаС2 + СО). Ионный характер связи приводит к высокой температуре плавления; например, карбид кальция СаС2 плавится при 2300° С, карбид тория ThC2 – при 2655° С. Водой или разбавленными кислотами ионные карбиды легко разлагаются – гидролизуются. При этом образуются различные углеводороды и гидроксид металла. Самый известный пример – получение ацетилена гидролизом карбида кальция: СаС2 + 2Н2О ® Ca(OH)2 + С2Н2. Ацетилен выделяется также при гидролизе Na2C2, К2С2 и др. Поэтому такие карбиды можно рассматривать как производные ацетилена, в которых атомы водорода замещены атомами металла. При этом катионы металла и анионы С2 –2 размещаются в соответствующих узлах кристаллической решетки. Солеобразный характер этих карбидов подтверждается возможностью их электролиза в расплавленном состоянии. Интересно отметить, что чистый карбид кальция – бесцветные кристаллы, хотя увидеть их непросто, так как обычный технический продукт имеет цвет от бурого до черного.
Взаимодействие карбидов щелочных металлов с водой протекает исключительно бурно. Так, если карбид калия просто облить водой, произойдет бурная реакция, которая сопровождается взрывом такой силы, что выделяющийся ацетилен сразу же разлагается с выделением угля. Чтобы провести реакцию К2С2 + 2Н2О ® 2КОН + С2Н2, надо медленно пропускать над карбидом водяной пар.
В ряде случаев карбиды ионного типа образуются непосредственно при пропускании ацетилена через растворы солей металлов. Так карбиды серебра, меди(I), золота и ртути, которые чаще называют ацетиленидами. Ацетилениды щелочных металлов можно получить действием ацетилена на свободные металлы. В сухом виде ацетилениды тяжелых металлов легко разлагаются со взрывом. Гидролиз ионных карбидов других металлов показывает, что они «происходят» из других углеводородов. Например, при гидролизе карбида алюминия выделяется метан: Al4C3 + 12H2O ® 4Al(OH)3 + 3CH4 (так же гидролизуется карбид бериллия Ве2С), а при гидролизе карбида магния получается метилацетилен: Mg2C3 + 4H2O ® 2Mg(OH)2+ НС≡С–СН3. Интересно, что карбид магния другого состава, MgC2, дает при гидролизе только ацетилен. Иногда при гидролизе ионных карбидов углеводороды выделяются совместно с водородом, который частично гидрирует непредельные углеводороды. С выделением почти равных количеств водорода и метана разлагается карбид марганца: Mn3C + 6H2O ® 3Mn(OH)2 + CH4 + H2. Карбиды редкоземельных металлов и тория при разложении разбавленными кислотами выделяют не чистый ацетилен, а его смесь с метаном, этиленом и другими углеводородами. Например, при гидролизе карбида церия СеС2 получается смесь ацетилена с метаном в соотношении 4:1, а также немного этилена и жидких и твердых углеводородов (состав продуктов зависит от условий проведения реакции). Еще больше жидких и твердых углеводородов дает при гидролизе карбид урана.
Выделение углеводородов при гидролизе карбидов позволило Д.И.Менделееву выдвинуть так называемую карбидную теорию происхождения нефти в глубинах Земли из неорганических веществ. По представлению Менделеева, в глубинах земного шара должны быть расплавленные металлы, в основном железо, которое с углеродом дает карбид. Во время горообразования в земной коре образуются трещины, по которым в глубины проникает вода. Воздействуя на карбид железа и карбиды других металлов, вода (в виде пара) образует углеводороды, например: 2FeC + 3H2O ® Fe2O3 + C2H4. Газообразные углеводороды по тем же трещинам поднимаются ближе к поверхности, где скапливаются в пористых пластах. Однако когда в 60-е гг. 20 в. был подробно изучен состав углеводородов нефти, оказалось, что смесь «искусственных углеводородов», образующихся при гидролизе карбидов, по своему составу резко отличается от природной смеси. Кроме того, все нефти, полученные неорганическим путем, оптически неактивны, тогда как природная нефть оптически активна. На основании этих, а также ряда других фактов неорганическая теория происхождения нефти была подвергнута критике, и в настоящее время многие ученые полагают, что нефть имеет биологическое происхождение.
Ко второй группе относятся карбиды, которые образуют переходные металлы IV–VII групп, а также кобальт, железо и никель. Это металлоподобные соединения с другой структурой. В них атомы углерода, имеющие небольшие размеры, не связаны друг с другом и располагаются в пустотах между атомами металлов. Различная упаковка атомов металла в кристаллической решетке приводит к разному составу карбидов даже для одного и того же металла; например, хром образует карбиды состава Cr3C2, Cr4C, Cr7C3 и др. Эти карбиды (их называют карбидами внедрения) часто отличаются большой твердостью и очень высокими температурами плавления. Например, карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890° С соответственно).
Металлоподобные карбиды обладают высокой электропроводностью и очень высокой химической стойкостью к агрессивным средам (многие из них не растворяются даже в царской водке). Они используются для упрочнения чугуна и стали (карбиды железа, хрома, вольфрама, молибдена), а также для производства очень твердых сплавов, которые применяют для обработки металлов резанием (карбиды WC, TiC, TaC, VC, Cr3C2). Например, твердые наконечники резцов, сверл делают из победита – спеченного порошка карбида вольфрама WC с добавкой металлического кобальта. Очень важную роль играет карбид железа Fe3C (цементит) – твердые кристаллы, входящие в структуру чугуна и стали.
Карбид вольфрама WC используют также для изготовления буровых коронок, деталей аппаратуры для производства синтетических алмазов, для нанесения износостойких покрытий на поверхности металлов. Карбид титана интересен ярким проявлением нестехиометрии: состав этого соединения выражается формулой TiCх, где х колеблется в пределах от 0,49 до 1 (см. СТЕХИОМЕТРИЯ). Это вещество, как и карбид вольфрама, используют как компонент жаропрочных, жаростойких и твердых сплавов, для получения износостойких покрытий, для изготовления тугоплавких тиглей, в которых можно плавить почти любые металлы (сам карбид плавится при 3257° С). Карбидом титана выкладывают внутренние стенки высокотемпературных печей.
К третьей группе относятся ковалентные карбиды. Их образуют кремний и бор – соседи углерода по периодической таблице, близкие к нему как по размеру атомов, так и по электроотрицательности. Карбид кремния SiC (техническое название – карборунд) в чистом виде – бесцветные кристаллы, но примеси часто окрашивают его в различные цвета, вплоть до черного. По своей структуре это соединение аналогично алмазу; решетку карбида кремния можно получить, если в немного расширенной решетке алмаза заменить половину атомов углерода на атомы кремния. Это вещество обладает очень высокой твердостью; помимо этого оно имеет свойства полупроводника. Из него делают шлифовальные бруски и круги, огнеупорные материалы для печей и литейных машин, нагревательные элементы для электропечей, полупроводниковые диоды.
Бор образует по два карбида с точно известной структурой – В4С и В13С2. Наибольшее значение имеет первый из них – черные блестящие кристаллы, которые по твердости уступают лишь алмазу и нитриду бора BN. Этот карбид применяют для изготовления абразивных и шлифовальных материалов и в качестве полупроводника. Карбид, обогащенный изотопом 10 В, используется как поглотитель нейтронов в ядерных реакторах.
Термин «карбиды» применяют к соединениям углерода, связанного с элементами меньшей или примерно равной электроотрицательности. Следовательно, продукты взаимодействия углерода с кислородом, серой, азотом, галогенами и т.д. не относятся к ним. По структуре и физико-химическим свойствам карбиды подразделяют на три группы: солеобразные с элементами I-III групп, карбиды внедрения с большинством переходных металлов, особенно IV-VI групп и ковалентные SiC и B4C. Все они получаются, как правило, путем восстановления углем соответствующих оксидов.
Бесцветные прозрачные кристаллы карбидов электроположительных металлов легко разрушаются водой или разбавленными кислотами с образованием углеводородов: метана или ацетилена. Первые из них, содержащие ион С 4‑ , называются метанидами, вторые ‑ ацетилениды ‑ включают ион С2 2‑ :
Карбиды внедрения построены за счет включения атомов углерода в октаэдрические пустоты кристаллической решетки металла с радиусом атома свыше 0,13 нм (например, вольфрама и циркония) без ее нарушения. Неискаженность решетки и высокая плотность упаковки частиц обусловливает высокие точки плавления (3000-4800 о С), большую твердость и металлическую проводимость истинных карбидов внедрения. В случае металла с меньшим радиусом атома (хром, железо, марганец, никель, кобальт) в присутствии углерода наблюдаются искажения решетки, а атомы углерода образуют слабо связанные цепи. При их гидролизе образуются гидроксиды соответствующих металлов и набор углеводородов, например:
Ковалентные карбиды кремния и бора — очень твердые, тугоплавкие и химически инертные вещества. Эти свойства обусловлены высокой симметрией и плотностью их кристаллической упаковки: среди трех модификаций SiC есть алмазоподобная, а структура В4С весьма своеобразна: атомы углерода образуют линейные группы С3, а атомы бора ‑ икосаэдр В12. Эти группы собираются ковалентными связями в совместную плотную упаковку.
Карбидообразование происходит при контакте графитового изделия с жидким металлом. Этот процесс ускоряет разрушение конструкционного материала при таком контакте, но он часто играет и положительную роль: карбидообразование облегчает жидкофазную графитацию и синтез искусственных алмазов. Кроме того, оно используется при модификации углеграфитовых материалов, повышающей их качество.
Реакции с газами
Реакции углеграфитовых материалов с газами достаточно подробно изучались в связи с высокотемпературной коррозией конструкционных материалов в атмосфере газообразных реагентов, особенно создающих окислительную среду (углекислый газ, кислород, пары воды). Эти реакции, независимо от природы конкретного газообразного реагента, протекают на поверхности графита через основные стадии хемосорбции с образованием и последующим разрушением поверхностного соединения. В таких процессах графит и вообще твердый углерод выступает не только как реагент, но и как гетерогенный катализатор. Скорость взаимодействия углерода с газом сильно зависит не только от аллотропной модификации реагента, но и от состояния его поверхности. Это позволяет стравливать газами дефектные участки поверхности изделия или удалять графитовую фазу в присутствии алмазной.
На примере реакции углерода с диоксидом углерода можно рассмотреть основные стадии подобных взаимодействий:
хемосорбция диоксида углерода поверхностью:

образование поверхностного соединения:

разложение промежуточного поверхностного соединения с образованием оксидов углерода:


Химизм реакций с другими кислородсодержащими газами принципиально не отличается от рассмотренного, меняется только набор конечных продуктов. Особенностью реакции с кислородом оказывается необратимость стадии хемосорбции:
что подтверждается отсутствием молекулярного кислорода в составе десорбирующихся с обработанной кислородом поверхности газов. Он включает только смесь оксидов углерода, как продуктов распада поверхностного соединения СxOy.



Отправить ответ