40 Мл 60 раствора ортофосфорной кислоты
Содержание:
Приготовление растворов. Раствором называют однородные смеси двух или более веществ. Концентрацию раствора выражают по-разному:
в весовых процентах, т.е. по количеству граммов вещества, содержащегося в 100 г раствора;
в объемных процентах, т.е. по количеству единиц объема (мл) вещества в 100 мл раствора;
молярностью, т.е. количеством грамм-молей вещества, находящегося в 1 л раствора (молярные растворы);
нормальностью, т.е. количеством грамм-эквивалентов раствореного вещества в 1 л раствора.
Растворы процентной концентрации. Процентные растворы готовят как приблизительные, при этом навеску вещества отвешивают на технохимических весах, а объемы отмеривают измерительными цилиндрами.
Для приготовления процентных растворов пользуются несколькими приемами.
Пример. Необходимо приготовить 1 кг 15%-ного раствора хлористого натрия. Сколько необходимо для этого взять соли? Расчет проводится согласно пропорции:
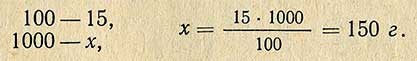
Следовательно воды для этого необходимо взять 1000-150 = 850 г.
В тех случаях, когда надо приготовить 1 л 15%-ного раствора хлористого натрия, необходимое количество соли рассчитывают другим способом. По справочнику находят плотность этого раствора и, умножив ее на заданный объем, получают массу необходимого количества раствора: 1000-1,184 = 1184 г.
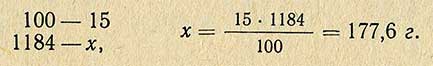
Следовательно, необходимое количество хлористого натрия различно для приготовления 1 кг и 1 л раствора. В тех случаях, когда приготовляют растворы из реактивов, содержащих в составе кристаллизационную воду, следует ее учитывать при расчете необходимого количества реактива.
Пример. Необходимо приготовить 1000 мл 5%-ного раствора Na2CO3 плотностью 1,050 из соли, содержащей кристаллизационную воду (Na2CO3-10H2O)
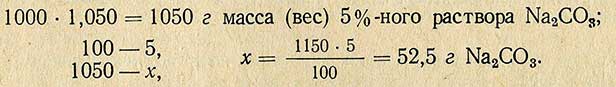
Молекулярная масса (вес) Na2CO3 равна 106 г, молекулярная масса (вес) Na2CO3-10H2O равна 286 г, отсюда рассчитывают необходимое количество Na2CO3-10H2O для приготовления 5%-ного раствора:
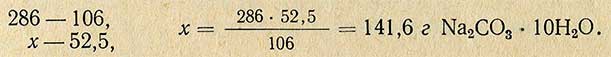
Методом разбавления растворы приготовляют следующим образом.
Пример. Необходимо приготовить 1 л 10%-ного раствора HCl из раствора кислоты относительной плотностью 1,185 (37,3%). Относительная плотность 10%-ного раствора 1,047 (по справочной таблице), следовательно, масса (вес) 1 л такого раствора равна 1000X1,047 = 1047 г. В этом количестве раствора должно содержаться чистого хлористого водорода
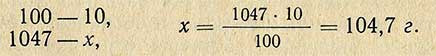
Чтобы определить, сколько необходимо взять 37,3%-ной кислоты, составляем пропорцию:
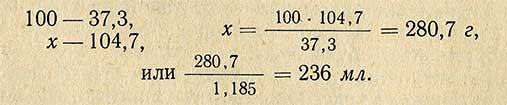
При приготовлении растворов путем разбавления или смешивания двух растворов для упрощения расчетов применяют способ диагональной схемы или «правило креста». На пересечении двух линий пишется заданная концентрация, а у обоих концов слева — концентрация исходных растворов, для растворителя она равна нулю.
Молярная концентрация (молярность) показывает, сколько моль вещества содержится в 1 л (1000мл) раствора. Молярность обозначается СМ — моль/л, (M), например, 1 моль/л, 0,5 М.
Нормальная концентрация (нормальность) показывает, сколько эквивалентов растворенного вещества содержится в 1л (1000мл) раствора. Нормальность раствора обозначают буквами СН – моль/л, (Н), например, 1 моль/л, 0,5 Н.
0,2 М раствора Na2SO4 — это означает, что в 1л (1000мл) содержится 0,2 моля Na2SO4 или 0,2∙106=21,2 г Na2SO4.
В 1 л 0,2 н раствора Na2SO4 содержится 0,2 моль эквивалентов соли или 0,2∙53=10,6 г Na2SO4.
Пример 6. Сколько граммов растворенного вещества содержится в 0,5 л 0,1 М раствора H2SO4?
Решение. 1 моль H2SO4 составляет 98 г
0,1 моль H2SO4 составляет Х г
1000 мл раствора содержат 9,8 г H2SO4
500 мл раствора содержат Х г H2SO4
 = 4,9 г H2SO4
= 4,9 г H2SO4
Пример 7. Определить молярную и нормальную концентрацию раствора Na2CO3 , в 2 л которого содержится 21,2 Na2CO3.
Решение. 2000 мл раствора содержат 21,2 г Na2CO3
1000 мл раствора содержат Х г Na2CO3
 = 10,6 г Na2CO3
= 10,6 г Na2CO3
Молярная масса Na2CO3 равна 106 г/моль следовательно,  моль.
моль.
Эквивалентная масса  г/моль, следовательно,
г/моль, следовательно, моль.
моль.
Ответ: 0,1 М, 0,2 н.
Пример 8. Определить молярность и нормальность 49 %-го раствора ортофосфорной кислоты (ρ =1,33) .
Решение. Известна процентная концентрация, т.е. содержание ортофосфорной кислоты 100 г раствора. Требуется определить, сколько грамм кислоты в 1000 мл раствора.
1000 мл ∙1,33 —- Х г,
 = 651,7 г.
= 651,7 г.
Масса одного моля H3PO4 составляет 98 г/моль.
Количество моль ортофосфорной кислоты составляет  =6,65 моль.
=6,65 моль.
Количество моль эквивалентов составляет  =19,95 моль, где 32,6 г/моль эквивалентная масса. Таким образом, в 1 литре кислоты содержится 6,65 моль кислоты и 19,95 эквивалентов кислоты. По определению это и есть молярная и эквивалентная концентрации.
=19,95 моль, где 32,6 г/моль эквивалентная масса. Таким образом, в 1 литре кислоты содержится 6,65 моль кислоты и 19,95 эквивалентов кислоты. По определению это и есть молярная и эквивалентная концентрации.
Ответ: 6,65 М, 19,95 н.
Пример 9. Для нейтрализации 30 мл 0,1 н раствора щелочи потребовалось 12 мл раствора кислоты. Определить нормальность кислоты.
Решение. Поскольку вещества взаимодействуют в эквивалентных количествах, то можно написать
 моль/л.
моль/л.
Задание к разделу III
Провести необходимые вычисления
1. К 3л 10%-ного раствора HNO3 (ρ =1,054 г/мл) прибавили 5 л 2%-ного раствора той же кислоты (ρ =1,009 г/мл). Определить С % и См если считать, что объем полученного раствора равен 8 л.
2. Из 700г 60%-ного раствора H2SO4 выпариванием удалили 200г воды. Чему равна массовая доля полученного раствора?
3. Сколько воды необходимо прибавить к 200 мл 68 %-го раствора азотной кислоты (ρ =1,4 г/мл), чтобы получить 10 %-й раствор?
4. К 1л 10 %-го раствора KOH (ρ = 1,092 г/мл) прибавили 0,5 л 5% — го раствора (ρ =1,045 г/мл). Смесь разбавили до 5 л. Вычислить См, Сн.
5. Сколько мл 96 %-й серной кислоты (ρ=1,84 г/мл) необходимо взять для приготовления 2л 0,5Н раствора кислоты?
6. Какой объем 2Н раствора азотной кислоты можно приготовить из 50мл 100 %-й азотной кислоты (ρ = 1,51 г/мл)?
7. Сколько мл 38 %-й НСI (ρ =1,19 г/мл) необходимо для приготовления 1л 2Н раствора?
8. К 100мл 96 %-го раствора H2SO4 (ρ = 1,84 г/мл) прибавили 400 мл воды. Получился раствора плотностью 1.225 г/мл. Определить С %, См.
9. Какой объем 96 %-й H2SO4 (ρ = 1,84 г/мл) необходимо взять для приготовления 250 мл 0,1М раствора?
10. Какие объемы 60 % H2SO4 (ρ = 1,5 г/мл) и 14 % — й H2SO4 (ρ = 1,1 г/мл) нужно смешать, чтобы получить 10 л 27 % -го раствора (ρ = 1,2 г/мл)?
11. Смешали 100мл 10 %-го гидроксида калия (ρ=1,08 г/мл) и 200мл 20%-ного раствора гидроксида натрия (ρ =1,22 г/мл). Вычислить молярную и нормальную концентрации гидроксида в полученном растворе.
12. Вычислить нормальность раствора KOH, полученного при сливании 100мл 10 %-го раствора (ρ = 1,08 г/мл) и 200 мл 20%-ного раствора (ρ = 1,2 г/мл), изменением объема при смешении можно пренебречь.
13. К 1л 60 %-го раствора ортофосфорной кислоты (ρ = 1.43) добавили 2л воды. Определить С % полученного раствора.
14. В 1л воды растворили 660 г KOH. Плотность полученного раствора 1,395. Определить С %, См, Сн.
15. К 100 мл 80 %-ного раствора HNO3 (ρ =1,46 г/мл) прибавили 400 мл воды. Получился раствор с плотностью 1,128 г/мл. Определить С % и Сн полученного раствора.
16. Сколько воды надо прибавить к 100 мл 48 %-ного раствора азотной кислоты (ρ = 1.3 г/мл ), чтобы получить 20 %-й раствор?
17. Сколько мл 56 %-й серной кислоты (ρ = 1, 46 г/мл) потребуется для приготовления 3л 1Н раствора?
18. 3,5 г технического едкого калия растворили в воде и получили 500 мл 0,1М раствора КОН. Каково процентное содержание КОН в образце?
19. Образец технической каустической соды содержит 92 % -й NaOH. Сколько граммов такой соды надо взять для приготовления 10 л 2М раствора NaOH?
20. Смешали два раствора: 500 мл 0,2М раствора NaOH и 2 л 0,1М раствора NaCl. Какова молярная концентрация NaOH и NaCl в полученном растворе?
21. Сколько мл 70 %-го раствора нитрата калия (ρ = 1,6 г/мл) нужно взять, чтобы получить 0,5 л 0,2Н раствора?
22. Смешали 100 мл 96 % -го раствора серной кислоты (ρ = 1,4 г/мл) и 100 мл 10 % — го раствора H2SO4 (ρ = 1,04 г/мл). Смесь разбавили водой до 3 л. Определить молярную и эквивалентную концентрации, полученного раствора.
23. Определить процентную концентрацию раствора, полученного при испарении 500 мл. воды из 1 л 5 % -го раствора хлорида натрия (ρ = 1,02 г/мл).
24. Сколько воды надо взять для приготовления 0,5 л 1,5 молярного раствора хлорида натрия из 10 г NaCl (ρ = 1,1 г/мл).
25. Вычислить нормальность раствора КОН, полученного при сливании 100 мл 10 % -го раствора (ρ = 1,08 г/мл) и 200 мл 20 % -го раствора (ρ = 1,2 г/мл). Объем полученного раствора принять равным 300 мл.
26. К 1 л 60 % -го раствора ортофосфорной кислоты (ρ = 1,43 г/мл) добавили 2 л воды. Определить процентную концентрацию.
27. В 600 мл раствора содержится 11, 76 г ортофосфорной кислоты. Определить молярную, нормальную и процентную концентрации.
28. Сколько мл 30 % го раствора азотной кислоты (ρ = 1,2 г/мл) нужно взять для приготовления 0,5 л 1 н раствора?
29. Вычислить процентную и молярную концентрации раствора, полученного при добавлении к 70 мл 4 % -го раствора бромида натрия (ρ = 1,2 г/мл) 10,5 г кристаллического NaBr.
30. К 100 мл 80 % -го раствора азотной кислоты (ρ=1,46 г/мл) прибавили 400 мл воды. Получился раствор с плотностью 1,128 г/мл. Определить процентную и нормальную концентрации раствора.
31. Сколько воды надо прибавить к 100 мл 48% раствора азотной кислоты (ρ=1,3 г/мл), чтобы получить 20 % раствор?
32. Сколько мл 56%-й серной кислоты (ρ=1,46 г/мл) потребуется для приготовления 3 л 1н раствора?
33. Сколько нитрата меди (II) содержится в 50 мл 0,96 н раствора?
34. Какой объем воды при комнатной температуре надо добавить к 0,5 л 40%-го раствора едкого кали (ρ = 1,43 г/мл) для приготовления 10 % -го раствора?
35. Определить процентное содержание вещества в растворе, приготовленном смешиванием 100 мл 1 – молярного раствора уксусной кислоты (ρ = 1,007 г/мл) и 10 мл 60 % -го раствора той же кислоты (ρ = 1,064 г/мл).
36. 3,5 г технического едкого кали растворили в воде и получили 500 мл 0,1 М раствора KOH. Каково процентное содержание KOH в образце?
37. Образец технической каустической соды содержит 92 %-го NaOH. Сколько граммов такой соды надо взять для приготовления 10 л 2М раствора NaOH?
38. Смешали два раствора 500 мл 0,2 М раствора и 2 л 0,1 М раствора NaCl. Какова молярная концентрация NaOH и NaCl в полученном растворе?
39. Определить процентное содержание вещества в растворе, приготовленном смешиванием 200 мл 0,2 М BaCl2 (ρ=1,034 г/мл) и 50 мл 24 % раствора BaCl2 (ρ=1,06 г/мл).
40. Сколько мл 70 % -го раствора нитрата калия (ρ=1,6 г/мл) нужно взять, чтобы получить 0,5 л 0,2 Н раствора?
41. Имеется 40 %-й раствор гидроксида натрия (ρ = 1,43 г/мл). Какой объем этого раствора нужно взять для приготовления 10 л 15 % раствора (ρ = 1,16 г/мл)?
42. Найти массы воды и медного купороса CuSO4 ∙5H2O , необходимого для приготовления 3 л раствора, содержащего 10% безводной соли (ρ = 1,09 г/мл).
43. Сколько граммов глауберовой соли Na2SO4 ∙10H2O следует растворить в 500 г воды для получения 20 % -го раствора Na2SO4?
45. Сколько граммов Na2НРO4 ∙12H2O требуется растворить в 1 л воды, чтобы получить 10 % -й раствор Na2НРO4?
46. Сколько граммов кристаллической соды Na2CO3 ∙ 10H2O необходимо взять для приготовления 100 г 0,5 % -го раствора Na2CO3?
47. Сколько молей MgSO4∙7H2O надо прибавить к 100 молям воды, чтобы получить 10 % -й раствор MgSO4?
48. Для борьбы с вредителями растений приготовлен раствор из 50 г BaCl2 ∙2H2O и 1 л воды, вычислить процентную концентрацию полученного раствора по безводной соли.
49. Сколько воды и буры Na2B4O7∙10H2O требуется для приготовления 1 кг 10% — го раствора Na2B4O7?
50. Сколько граммов кристаллогидрата СaCl2∙6H2O требуется для приготовления 7 л 0,25 н раствора СaCl2?
51. Сколько граммов NiCl2 ∙6H2O необходимо растворить в 1 л воды, чтобы получить 20 % раствор по безводной соли?
52. Сколько граммов FeSO4 ∙7H2O необходимо добавить к 400 мл 10 % раствора (ρ=1,1 г/мл) для получения 20 % -го раствора FeSO4?
53. Определить массу осадка BaCl2∙2H2O , который образуется из 5 л 1М раствора BaCl2.
54. Сколько граммов СuSO4 ∙5H2O и воды необходимо для приготовления 500 г 18 % -го раствора СuSO4 (ρ=1,2 г/мл)?
55. Сколько граммов щавелевой кислоты H2C2O4∙2H2O надо взять для приготовления 500 мл 0,02 н раствора H2C2O4 ?
56. Сколько мл 0,5 н раствора BaCl2 можно приготовить из 24,4 г BaCl2 ∙2H2O?
57. Сколько граммов медного купороса (CuSO4 ∙5H2O) образуется из 50 мл 0,2 н раствора CuSO4?
58. Определить молярную концентрацию FeSO4 полученного растворением в 0,5 л раствора 11,44 г FeSO4 ∙7H2O.
59. Определить процентную концентрацию раствора SrCl2 полученного растворением 84 г кристаллогидрата SrCl2∙6H2O в 100 г воды.
60. Сколько граммов глауберовой соли Na2SO4∙10H2O следует растворить в 500 г воды для получения 20 % -го раствора Na2SO4?
61. Определить молярную концентрацию CoCl2 полученного растворением в 1,2 л раствора 9,5 г CoCl2 ∙6H2O.
62. Определить молярную и эквивалентную концентрации растворенных веществ в следующих растворах
а) 16% раствора сульфата меди (ρ=1,18 г/мл).
б) 20% раствора хлорида цинка (ρ=1,17 г/мл).
в) 5% раствора ортофосфорной кислоты(ρ=1,2 г/мл).
г) 30,1% раствора азотной кислоты (ρ=1,185 г/мл).
д) 10% раствора сульфата натрия(ρ=1,1 г/мл).
е) 60% раствора уксусной кислоты (ρ=1,8 г/мл).
ж) 6% раствора ортоборной кислоты (ρ=1,2 г/мл).
з) 98% раствора серной кислоты (ρ=1,84 г/мл).
63. Определить молярную и процентную концентрации растворенных веществ в следующих растворах:
а)10 н раствора сульфата меди (ρ=1,18 г/мл).
б) 7,98 н раствора хлорида цинка (ρ=1,17 г/мл).
в) 5 н раствора ортофосфорной кислоты(ρ=1,27 г/мл).
г) 3,5 н раствора азотной кислоты (ρ=1.185 г/мл).
д) 1 н раствора сульфата натрия(ρ=1,1 г/мл).
е) 6 н раствора уксусной кислоты (ρ=1.068 г/мл).
ж) 4 н раствора ортоборной кислоты (ρ=1.2 г/мл).
з) 2 н раствора серной кислоты (ρ=1,84 г/мл).
64. Из 5 г карбоната натрия приготовлено 500 мл раствора. Какова нормальность и молярность этого раствора?
65. Какова процентная концентрация 5М раствора серной кислоты (ρ=1,29 г/мл), 2 н раствора сульфата никеля (II) (ρ=1,14 г/мл)?
66. К 100 мл 96 % раствора серной кислоты (ρ=1,84 г/мл) прибавили 400 мл воды. Определить ω и молярную концентрации полученного раствора (ρ=1,22 г/мл).
67. Сколько мл 5 %-го раствора серной кислоты (ρ=1,32 г/мл) пойдет на приготовление 2 л 0,5 н раствора серной кислоты?
68. 250 мл 96 %-го раствора серной кислоты (ρ=1,84 г/мл) разбавили водой до 1000 мл. Определить нормальную и молярную концентрации полученного раствора.
69. Сколько воды нужно прибавить к 200 мл 60 %-го раствора азотной кислоты (ρ=1,4 г/мл), чтобы получить 2 н раствор?
70. Сколько воды нужно выпарить из 2 л 1 М раствора гидроксида натрия, чтобы получить 10 %-го раствор (ρ=1,1 г/мл)?
71. До какого объема нужно разбавить 200 мл 20 %-го раствора хлорида меди (ρ=1,2 г/мл), чтобы получить 0,5 М раствор?
72. Сколько мл 2н раствора нитрата хрома (III) требуется для получения 0,2 молей гидроксида хрома (III)?
73. На нейтрализацию 250 мл 0,1 н раствора серной кислоты пошло 150 мл раствора гидроксида натрия. Какова нормальность раствора едкого натрия?
74. Сколько граммов серной кислоты содержится в 300 мл раствора, если на нейтрализацию его израсходовано 8 мл 1 н раствора гидроксида калия?
75. В 50 мл раствора содержится 0,5 г едкого натра. На нейтрализацию этого объема раствора потребовалось 25 мл раствора кислоты. Какова нормальность раствора?
76. Какова нормальная концентрация раствора нитрата серебра, если на реакцию с 0,924 г хлорида натрия израсходовано 16 мл раствора этой соли?
77. Сколько мл 20 %-го раствора серной кислоты (ρ=1,14 г/мл) вступило в реакцию с цинком, если при этом выделилось 56 л водорода? Сколько граммов цинка участвовало в реакции?
78. К раствору хлорида аммония добавили 100 мл 25 %-го раствора КОН (ρ=1,23г/мл). Вычислите объем выделившегося газа.
79. Какое количество моль сернистого газа необходимо пропустить через 200 мл 30% раствора NaOH (ρ=1,33 г/мл) для образования кислой соли?
80. Сколько требуется взять 2М раствора хлорноватистой кислоты, чтобы при взаимодействии его с карбонатом натрия получить 10 л СО2 у.н.?
81. Какой объем 20 %-го раствора гидроксида калия (ρ = 1,18 г/мл) необходимо взять для реакции с 200 мл 2 %-го раствора хлорида цинка (ρ = 1,02 г/мл), чтобы получить осадок гидроксида цинка?
82. Раствор, содержащий нитрат бария, смешан с 42 мл 26% раствора сульфата натрия (ρ = 1,3 г/мл). Сколько граммов сульфата бария образовалось?
83. Смешали 100 мл 4 %-го раствора хлороводородной кислоты (ρ=1,01 г/мл) и 50 мл 1М раствора гидроксида натрия. Сколько граммов соли образовалось? Какое вещество и в каком количестве взято в избытке?
84. Сколько мл 6,75 % -го раствора серной кислоты (ρ = 1,16 г/мл) требуется для реакции с раствором, содержащем 6,1 г BaCl2∙2H2O?
85. На 80 г цинка, содержащего 10% примесей, действуют 200 мл 20% -го раствора хлорноватистой кислоты (ρ=1,1 г/мл). Сколько хлорида цинка образовалось в результате реакции?
86. На 80 г цинка, содержащего 10 % примесей, действуют 200 мл 20 % -го раствора хлороводородной кислоты (ρ=1,1 г/мл). Сколько хлорида цинка образуется в результате реакции?
87. Сколько карбоната кальция получится при реакции 2,8 л СО2 и 200 г 5% — го раствора гидроксида кальция?
88. Какова нормальность раствора HCl, если на взаимодействие с 19,46 г карбоната натрия идет 2 л этого раствора?
89. При пропускании хлора через 500 мл раствора иодида калия вес выделившегося иода составил 75 г. Вычислить молярную концентрацию раствора иодида калия.
90. Для осаждения в виде BaSO4 всего бария, содержащегося в 500 мл раствора BaCl2 потребовалось 100 мл 0,3 н раствора H2SO4. Сколько граммов BaSO4 выпало в осадок? Чему равна нормальность раствора?
91.Какой объем 1 н раствора KOH потребуется для образования сульфида калия с сероводородом, полученным при взаимодействии сульфида железа (II) c 0,7 л 20 %-го раствора HCl (ρ=1,1 г/мл)?
92. Плотность раствора Na2CO3 равна 1,1 г/мл. Из 4 л этого раствора при действии соляной кислоты получено 60 л СО2 (н.у.). Вычислите процентную концентрацию Na2CO3 в этом растворе.
93. Какой объем 4 н раствора H2SO4 может взаимодействовать 0,65 л 20% раствора К2CO3 (ρ =1,19 г/мл)? Какой объем займет выделившийся газ при н.у.?
94. К 0,05 л 8 %-го раствора хлорида марганца (ρ=1,085 г/мл) прибавлено 0,2 л 10 %-го раствора гидроксида лития (ρ = 1,1 г/мл). Какое вещество взято в избытке и сколько его останется после реакции?
95. К 0,1 л 20% раствора хлорида бария (ρ=1,2 г/мл) прибавлен раствор сульфата хрома (III). Вычислить массу образовавшегося осадка BaSO4.
96. Какова масса Al(OH)3, если для его растворения потребовалось 0,2 л 30% раствора HNO3 (ρ=1,18)? Какой объем 2,5 н КОН необходимо затратить для растворения этого количества гидроксида алюминия?
97. Сколько миллилитров 8 % -го раствора NaOH (ρ=1,09 г/мл) требуется для нейтрализации 75 мл раствора H2SO4 , если известно, что из10 мл того же раствора можно получить 0,2334 г BaSO4.
98. Сколько молей хлорной кислоты необходимо для нейтрализации 1,5 л 0,25 М раствора гидроксида кальция?
99. Сколько миллилитров 8 %-го раствора едкого натра (ρ=1,1 г/мл) необходимо для растворения 8,1 г оксида цинка (II).
Автор: Хельга, 7 сентября, 2011 в ПОМОЩЬ
Рекомендуемые сообщения
Создайте аккаунт или войдите в него для комментирования
Вы должны быть пользователем, чтобы оставить комментарий
Создать аккаунт
Зарегистрируйтесь для получения аккаунта. Это просто!



Отправить ответ