Ацетилен взаимодействует с водой
Содержание:
АЦЕТИЛЕН (от лат. acetum-уксус и греч. hyle — лес, дерево; вещество) (этин) СН СН, мол. м. 26,04; бесцв. газ; т. пл. -81°С/1277мм рт. ст., т. возг. -84,1°С; т. кип. -83,8°С; плотн. 1,0896 г/л (газ; 20°С; 101 кПа);
СН, мол. м. 26,04; бесцв. газ; т. пл. -81°С/1277мм рт. ст., т. возг. -84,1°С; т. кип. -83,8°С; плотн. 1,0896 г/л (газ; 20°С; 101 кПа); 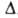 Н°о6р -227,400 кДж/моль (газ; 298,15 К),
Н°о6р -227,400 кДж/моль (газ; 298,15 К),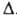 Н°сгор — 1307 кДж/моль; Сp o 44,036 Дж/(моль*К); давление пара жидкого ацетилена (МПа): 1,1 (-30°С), 2,6 (0°С), 5,4 (30°С); tкрит 35,2°С, pкрит 6,4 МПа; макс. т-ра кислородно-ацетиленового пламени 3150°С (при содержании ацетилена 45% по объему), воздушно-ацетиленовой смеси 2350 °С. Р-римость (объемы ацетилена) в 1 объеме р-рителя при 15°С и 101 кПа: в воде-1,15; ацетоне-25 (при 1,2 МПа-300; при -80°С и 0,1 МПа-2000); спирте-6; бензоле-4; уксусной к-те-6 (18°С); ДМФА -33,5 (25 °С).
Н°сгор — 1307 кДж/моль; Сp o 44,036 Дж/(моль*К); давление пара жидкого ацетилена (МПа): 1,1 (-30°С), 2,6 (0°С), 5,4 (30°С); tкрит 35,2°С, pкрит 6,4 МПа; макс. т-ра кислородно-ацетиленового пламени 3150°С (при содержании ацетилена 45% по объему), воздушно-ацетиленовой смеси 2350 °С. Р-римость (объемы ацетилена) в 1 объеме р-рителя при 15°С и 101 кПа: в воде-1,15; ацетоне-25 (при 1,2 МПа-300; при -80°С и 0,1 МПа-2000); спирте-6; бензоле-4; уксусной к-те-6 (18°С); ДМФА -33,5 (25 °С).
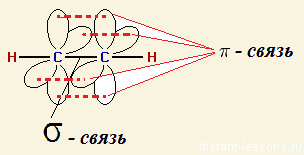
Атомы углерода в ацетилене sp-гибридизованы. Они связаны одной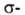 и двумя
и двумя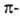 связями, макс. плотности к-рых расположены в двух взаимно перпендикулярных областях, образуя цилиндрич. облако
связями, макс. плотности к-рых расположены в двух взаимно перпендикулярных областях, образуя цилиндрич. облако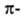 электронной плотности; за его пределами находятся атомы Н (см. рис.).
электронной плотности; за его пределами находятся атомы Н (см. рис.).
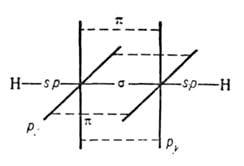
Молекула ацетилена линейна; все 4 атома расположены на прямой. Расстояния С С и С—Н равны соотв. 0,1205 и 0,1059 нм. Энергия тройной связи 836 кДж/моль. В ИК-спектрах несимметричной ацетиленовой группы (RC
С и С—Н равны соотв. 0,1205 и 0,1059 нм. Энергия тройной связи 836 кДж/моль. В ИК-спектрах несимметричной ацетиленовой группы (RC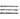 СН) имеются полосы поглощения валентных колебаний при частотах
СН) имеются полосы поглощения валентных колебаний при частотах 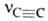 2260-2100 см -1 , vС_H 3310-3300 см -1 и деформационных колебаний
2260-2100 см -1 , vС_H 3310-3300 см -1 и деформационных колебаний 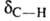 700-610 см’ 1 . В спектрах ЯМР хим. сдвиг протона составляет 2,0 м.д., ядер 13 С-68 м.д. (для C2H5G
700-610 см’ 1 . В спектрах ЯМР хим. сдвиг протона составляет 2,0 м.д., ядер 13 С-68 м.д. (для C2H5G CH). Ацетиленовая группа не поглощает УФ-излучение с длиной волны более 200 нм.
CH). Ацетиленовая группа не поглощает УФ-излучение с длиной волны более 200 нм.
Для ацетилена характерны р-ции присоединения, к-рые происходят в две стадии: сначала образуются замещенные этилена, затем — замещенные алканов. Галогены присоединяются непосредственно, галогеноводороды — в присут. катализаторов (напр., CuCl, HgCl2):
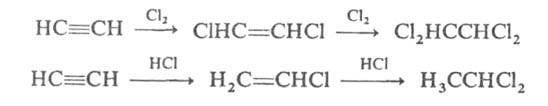
Эти р-ции используются при произ-ве тетрахлорэтилена, трихлорэтилена, винилхлорида и др. хлорсодержащих соединений.
Водород присоединяется в присут. катализаторов (Ni, Pt или др.): СН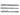 СН -> СН2=СН2 -> СН3СН3; вода — в присут. солей Hg 2+ с образованием ацетальдегида (Кучерова реакция). Прямая гидратация происходит при пропускании смеси ацетилена и паров воды при 300-400°С над фосфатами тяжелых металлов. Гидратация ацетилена используется в пром-сти для произ-ва ацетальдегида и продуктов дальнейших его превращений — уксусной к-ты, ацетона, спирта. В присут. CuCl в кислой среде HCN присоединяется к ацетилену с образованием акрилонитрила. Ацетилен легко присоединяет сулему в виде р-ра в 10-12%-ной соляной к-те:
СН -> СН2=СН2 -> СН3СН3; вода — в присут. солей Hg 2+ с образованием ацетальдегида (Кучерова реакция). Прямая гидратация происходит при пропускании смеси ацетилена и паров воды при 300-400°С над фосфатами тяжелых металлов. Гидратация ацетилена используется в пром-сти для произ-ва ацетальдегида и продуктов дальнейших его превращений — уксусной к-ты, ацетона, спирта. В присут. CuCl в кислой среде HCN присоединяется к ацетилену с образованием акрилонитрила. Ацетилен легко присоединяет сулему в виде р-ра в 10-12%-ной соляной к-те:
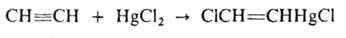
Действием AsCl3 на это соединение получают хлорвинилдихлорарсин (люизит):
хлорвинилдихлорарсин (люизит):
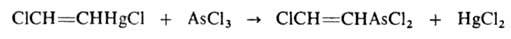
Спирты присоединяются к ацетилену в присут. КОН, BF3 или HgO при 150-200°С Продукты р-ции — простые виниловые эфиры, используемые в произ-ве полимеров, смазочных масел, эмульгаторов и др. Аналогично к ацетилену могут присоединяться карбоновые к-ты (кат. — HgSO4, ацетаты Zn или Cd на активиров. угле), амины, амиды к-т, тиолы и др. с образованием виниловых соед., напр.:
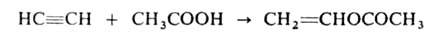
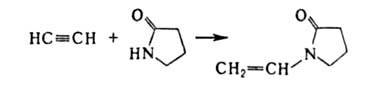
Ацетилен легко присоединяет альдегиды и кетоны в присутствии щелочных катализаторов (реакция Фаворского). Большое практическое значение имеет реакция ацетилена с формальдегидом в присутствии ацетиленида Си (реакция Реппе):
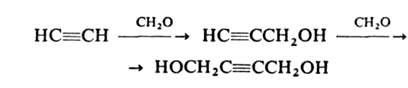
Образующиеся пропаргиловый спирт и 2-бутин-1,4-диол — исходные вещества в производстве 1,4-бутиленгликоля. При взаимод. ацетилена с СО и спиртами, NH3 или аминами в присут. Ni(CO)4 под давлением получают эфиры или амиды акриловой кислоты, используемые в синтезе полимеров:
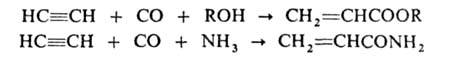
Карбонилирование м. б. использовано также для синтеза бензохинона:
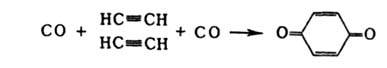
Под влиянием солей Cu(I) в водном НCl ацетилен димеризуется в винилацетилен, из к-рого получают хлоропрен. Над активным углем ацетилен гладко тримеризуется в бензол. В присут. Ni(CN)2 в тетрагидрофурана ацетилен превращается в циклооктатетраен С8Н8 (р-ция Реппе), в присут. Н2 над Ni — в изобутилен.
Для ацетилена характерны также р-ции, обусловленные слабокислым характером ацетиленовой группы (рКа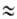 25). При действии щелочных, щел.-зем. металлов (при нагревании, легче — в жидком NH3) или металлоорг. соед. образуются продукты замещения водорода в ацетилене металлами, т. наз. ацетилениды МС
25). При действии щелочных, щел.-зем. металлов (при нагревании, легче — в жидком NH3) или металлоорг. соед. образуются продукты замещения водорода в ацетилене металлами, т. наз. ацетилениды МС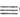 СН, к-рые энергично реагируют с водой, регенерируя ацетилен. С магнийорг. соед. ацетилена легко образует магнийгалогенопроизводные ацетилена (реактивы Иоцича). Ацетилениды Mg, Na, Li часто используют в орг. синтезе для введения ацетиленовой группы. Так, при взаимод. с алкилирующими агентами образуются алкилацетилены (напр., метилацетилен, 1-бутин, 1-пентин): RX + МС
СН, к-рые энергично реагируют с водой, регенерируя ацетилен. С магнийорг. соед. ацетилена легко образует магнийгалогенопроизводные ацетилена (реактивы Иоцича). Ацетилениды Mg, Na, Li часто используют в орг. синтезе для введения ацетиленовой группы. Так, при взаимод. с алкилирующими агентами образуются алкилацетилены (напр., метилацетилен, 1-бутин, 1-пентин): RX + МС СН -> RC
СН -> RC СН + MX. Дизамещенные ацетилениды Сu2С2 и Ag2C2 образуются при действии на ацетилен аммиачных р-ров соотв. солей Cu(I) и Ag; эти ацетилениды взрывоопасны, напр. Сu2С2 взрывается около 120°С. Образование Сu2С2 красного цвета часто используют для определения ацетилена. См. также Ацетиленовые комплексы переходных металлов.
СН + MX. Дизамещенные ацетилениды Сu2С2 и Ag2C2 образуются при действии на ацетилен аммиачных р-ров соотв. солей Cu(I) и Ag; эти ацетилениды взрывоопасны, напр. Сu2С2 взрывается около 120°С. Образование Сu2С2 красного цвета часто используют для определения ацетилена. См. также Ацетиленовые комплексы переходных металлов.
При сжигании ацетилена выделяется большое кол-во тепла. На этом основана ацетилено-кислородная сварка черных металлов (на сварку расходуется около 30% производимого ацетилена).
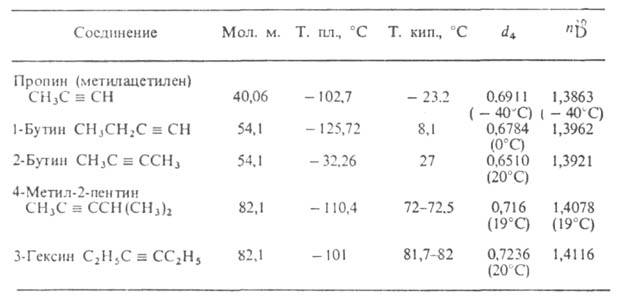
Ацетилен-родоначальник ряда ацетиленовых углеводородов (см. табл.), хим. св-ва к-рых также определяются наличием тройной связи С С. Методы получения ацетилена в пром-сти:
С. Методы получения ацетилена в пром-сти:
1. Разложение карбида кальция водой:
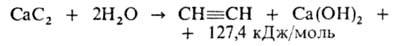
Поскольку р-ция экзотермична, необходим строгий контроль за т-рой, т. к. при перегреве ацетилен легко разлагается, что может привести к взрыву. Используют генераторы производительностью до 2000 м 3 /ч. Примеси (NH3, PH3, AsH3, сульфиды и др.) удаляют окислением водными р-рами NaCIO, FcCl3 или Н2СrO4.
2. Электрокрекинг прир. газа (метана с примесью гомологов) в электродуговых печах:
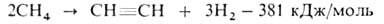
Метан пропускают между металлич. электродами при нормальном давлении, т-ре 1600°С, времени контакта доли секунды; смесь образовавшихся газов резко охлаждают водой. Полученный газ содержит 12-15% по объему ацетилена (теоретически возможно 25%), к-рый выделяют р-рением в воде под давлением. Из 1000 м 3 прир. газа получают 300 кг ацетилена, 26 кг этилена, 21 кг сажи и 1170 м 3 Н2. Расход электроэнергии ок. 9 кВт-ч на 1 кг неочищенного ацетилена. 3. Термоокислит. крекинг (частичное окисление) прир. газа благодаря теплу, выделяющемуся при частичном сгорании метана (СН4:О2 = 1 :0,65):
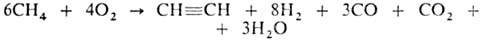
4. Пиролиз прир. газа. Над огнеупорной насадкой пропускают смесь газа с воздухом, к-рая, сгорая, нагревает насадку до
1500°С, а затем на насадке происходит пиролиз газа-метана, разбавленного обратным газом (после выделения ацетилена) и водяным паром в соотношении 1:2:6. Операции повторяют многократно.
СВОЙСТВА АЦЕТИЛЕНОВЫХ УГЛЕВОДОРОДОВ
В газах, полученных методами 3 и 4, содержание ацетилена редко достигает 20%. Выделить его из сложной смеси продуктов довольно трудно; чаще всего используют растворение в ДМФА или др. селективных р-рителях. Экономич. затраты на произ-во ацетилена термоокислит. крекингом и пиролизом вполне сравнимы с затратами по карбидному методу. Кроме того, эти методы выгодно отличаются от карбидного отсутствием прямого расхода электроэнергии и использованием в кач-ве сырья прир. газа. Производств. мощности по ацетилену в промышленно развитых странах составляют сотни тысяч т/год.
Ацетилен взрывается при т-ре ок. 500°С или давлении выше 0,2 МПа; КПВ 2,3-80,7%, т. самовоспл. 335°С Взрывоопасность уменьшается при разбавлении ацетилена др. газами, напр. N2, метаном или пропаном. Ацетилен обладает слабым токсин, действием; ПДК 0,3 мг/м 3 . Хранят и перевозят его в заполненных инертной пористой массой (напр., древесным углем) стальных баллонах белого цвета (с красной надписью "А") в виде раствора в ацетоне под давл. 1,5-2,5 МПа. Ацетилен открыт Э.Дэви в 1836. Впервые синтезирован в 1862 М. Бертло из угля и Н2.
===
Исп. литература для статьи «АЦЕТИЛЕН» : Ньюлэнд Ю.А., Фогт P.P., Химия ацетилена, пер. с англ., М., 1947; Федоренко Н. П.. Методы получения ацетилена. М.. 1958; Кононов Н. Ф.. Островский С. А.. Устынюк Л.А.. Новая технология некоторых синтезов на основе ацетилена, М., 1977; Котляревский И. Л., Карпицкая Л.Г., Химия ацетилена. Томск. 1981; Kirk-Othmer encyclopedia. 3 ed., v. 1, N. Y., 1978, p. 192-243; The chemistry of the carbon-carbon triple bond, ed. by S. Patai. N.Y.. 1978. И.Л.Кнунянц.
Страница «АЦЕТИЛЕН» подготовлена по материалам химической энциклопедии.
Газообразный
Жидкий
Ацетилен — ненасыщенный углеводород C2H2. Имеет тройную связь между ат омами углерода, принадлежит к классу алкинов.
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах.Взрывоопасный. Нельзя выпускать на открытый воздух. Частицы C2H2 есть на Уране и Нептуне.
Химические свойства
Ацетилено-кислородное пламя(температура «ядра» 3300 °C)
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекулавысокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании температура пламени достигает 3300°С. Ацетилен можетполимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метаниз эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра иодновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):

История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В промышленности ацетилен часто получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.), а также при дегидрировании двух молекул метана при температуре свыше 1400° Цельсия.
Применение
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидка),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
Безопасность
Поскольку ацетилен растворим в воде и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры. Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например N2, метаном или пропаном. При длительном соприкосновении ацетилена с медью или серебром образуется взрывчатая ацетиленистая медь или ацетиленистое серебро, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов). Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 "Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест". ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), т.к. концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100%. Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Это вещества еще с меньшим количеством углерода, чем у алканов и алкенов . Тройная связь определяет и строение молекул, и общую формулу, и химические свойства алкинов.
Для атомов тройной связи характерна Sp-гибридизация. Т.е. тройная связь — это комбинация одной σ- и двух Π-связей:
Общая формула:

n = числу атомов углерода.
Название углеводородов строятся из двух частей.
Первая часть «говорит» о количестве атомов углерода, вторая — о тройной связи. У алкинов вторая часть — всегда -ин.
- в качестве основной цепи выбирается та, в которой находится тройная связь, не зависимо от ее размера,
- нумерация идет с того конца, к которому ближе тройная связь
- после окончания -ин ставится номер атома, после которого идет тройная связь.
Изомерия
Соответственно, для алкинов характерны 2 вида изомерии:
- Структурная — изомерия положения тройной связи и изомерия радикалов
- Межклассовая — алкины изомерны акладиенам.
Химические свойства алкинов:
1. Тройная связь, как и двойная , все присоединяет, разрывается, образует двойную связь, если реагент дан в избытке, то реакция может идти до образования одинарной связи:
- галогенирование,
- гидрогалогенирование,
- гидрирование:

2. Гидратация — взаимодействие с водой — реакция Кучерова :

3. Качественные реакции алкинов:
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I) . Эта реакция служит для обнаружения алкинов с тройной связью на конце цепи:

4. Реакции окисления:
Алкины окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи и образуются карбоновые кислоты, перманганат восстанавливается до Mn(2+) — в кислой среде, MnO2 — в щелочной:
5. Реакции горения: как и все органические вещества, алкины сгорают с образованием углекислого газа и воды:
СnH2n-2 + (3n-1)2 O2 → nCO2 + (n-1) H2O
Здесь записано уравнение в общем виде, т.к. во многих задачах требуется определить состав углеводорода — в таких случаях любые реакции лучше записывать в таком — общем виде.
Получение алкинов:
- Из неорганических соединений: CaC2 + 2H2O → Ca(OH)2 + C2H2
- дегидрогалогенирование: СH3-СHBr2 +2KOH (этанол, t) →C2H2 + 2KBr + 2H2O
Пример олимпиадного вопроса (2015 г)

Общая формула СnH2n-2, что соответствует либо алкинам, либо алкадиенам
Структурные изомеры алкинов:
Межклассовые — алкадиены:
- СH2=СH-СH=СH2 — бутадиен-1,3
- CH2=C=CH-CH3 — бутадиен-1,2
- в ЕГЭ это вопрос А13 и А14— Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2— Первоначальные сведения об органических веществах: предельных и непредельных углеводородах



Отправить ответ