Кристаллическая решетка металлов образована
Содержание:
- 1 Ионные кристаллические решетки
- 2 Атомные кристаллические решетки
- 3 Молекулярные кристаллические решетки
- 4 Решетка металлов
- 5 Кристаллическое строение металлов. Кристаллическая решетка металлов. Металлы в периодической системе Менделеева
- 6 Периодическая таблица и металлы
- 7 Что такое металл и чем он отличается от неметалла?
- 8 Какие металлы бывают?
- 9 Черные и цветные металлы
- 10 Металлическая связь
- 11 Кристаллическое строение металлов. Типы кристаллических решеток
- 12 Решетки ГЦК, ОЦК, ГПУ
- 13 Понятие об индексах Миллера
- 14 Дефекты в металлах
- 15 Влияние дефектов на свойства
- 16 Реальный кристалл металла
Рис . кристаллическая решетка хлорида натрия
Ионные кристаллические решетки
Электрическое поле иона равномерно распределено в пространстве, поэтому ионная связь характеризуется отсутствием направленности и насыщаемости. Энергетически наиболее выгодно, чтобы каждый ион был окружен наибольшим числом ионов противоположного знака. Но одноименно заряженные ионы отталкиваются, поэтому устойчивыми будут только такие кристаллические решетки, для которых выполняются следующие два условия: разноименные ионы максимально сближены; одинаково заряженные ионы максимально удалены друг от друга.
Радиусы ионов играют основную роль при образовании тех или иных кристаллических форм. Так, если отношение радиуса катиона (rк) к радиусу аниона (rа) превышает 0,73, геометрически легко показать, что каждый ион может быть окружен восемью ионами противоположного знака. При чк: ча=0,41÷0,73 наблюдается октаэдрическая координация: вокруг каждого иона располагаются шесть противоположно заряженных ионов. И наконец, при чк: ча + в кристалле NaCl окружен шестью ионами хлора, а каждый анион Сl — — шестью ионами натрия. За счет равномерного распределения электронной плотности в пространстве все шесть связей оказываются совершенно равноценными. В кристалле хлорида натрия нельзя выделить отдельных ионных молекул Na + Cl — ; его необходимо рассматривать как гигантскую макромолекулу, построенную из равного числа катионов Na + и анионов Сl — (рис.).
Таблица 8 Ионные радиусы галогенов и щелочных металлов
| Катион | Радиус, нм | Анион | Радиус, нм |
| Li + | 0,078 | F — | 0,133 |
| Na + | 0,095 | Сl — | 0,181 |
| К + | 0,133 | Вr — | 0,196 |
| Cs + | 0,165 | I — | 0,220 |
Для хлорида цезия отношение чк:ча равно 0,91. Восемь катионов Cs + занимают вершины куба, в центре которого находится ион хлора.
 При обычных условиях ионные соединения представляют собой хрупкие твердые вещества с высокими температурами плавления. Их переход в жидкое состояние происходит обычно с увеличением объема.
При обычных условиях ионные соединения представляют собой хрупкие твердые вещества с высокими температурами плавления. Их переход в жидкое состояние происходит обычно с увеличением объема.
Рис.2. Структура алмаза
Ионные кристаллы, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например, в воде. Расположенные на поверхности ионы окружаются молекулами растворителя, отрываются от кристалла и переходят в раствор. Для одного и того же ионного соединения растворимость возрастает с увеличением взаимодействия между молекулами растворителя и соответствующими ионами кристалла, т. е. с увеличением полярности растворителя (табл.9).
Растворимость кристаллических ионных соединений в различных полярных растворителях
(температура 25°С; растворимость выражена в граммах растворенного вещества на 100 г растворителя; е — диэлектрическая проницаемость)
| Соединение | Растворимость в спиртах | ||
| метиловом (ε = 33) | этиловом (ε= 24) | пропиловом (ε= 20) | |
| KI | 90 | 46 | 28 |
| NaCl | 0,53 | 0,02 | 0,00 |
| Sr(NO3)2 | 1,26 | 0,02 | — |
Атомные кристаллические решетки
Атомные кристаллические решетки сформированы за счет ковалентных связей. Взаимная ориентация атомов определяется пространственным строением их электронных подуровней. Например, каждый атом углерода может образовать четыре ковалентные связи, направленные из центра правильного тетраэдра к его вершинам. С этим центральным атомом соединяются четыре атома углерода, находящихся в том же валентном состоянии. У каждого из этих атомов остается по три неспаренных электрона, занимающих три гибридных s р 3 -подуровня, поэтому они образуют связи с тремя другими атомами углерода. Так строится трехмерная кристаллическая решетка алмаза (рис. 2). Чтобы такой кристалл расплавился, необходимо разорвать большую часть ковалентных углерод-углеродных связей, обладающих высокой энергией. Поэтому алмаз плавится при очень высокой температуре (>3500°С) и его невозможно растворить в какой-либо жидкости.
Атомные кристаллы с ковалентными связями являются в большинстве случаев изоляторами, поскольку в них отсутствует как ионная , так и электронная проводимость.
Молекулярные кристаллические решетки
В узлах молекулярной кристаллической решетки находятся молекулы, связанные между собой силами Ван-дер-Ваальса. Такие решетки образуют водород, хлор, азот, оксид углерода (IV) и многие органические соедини. Вследствие небольшой энергии взаимо действия частиц молекулярные кристаллы плавятся при низких температурах и легко растворяются в различных жидкостях (табл. 10).
Молекулы, имеющие разветвленное строение, образует более компактную кристаллическую структуру. Силы Взаимодействия между ними оказываются при этом гораздо выше, чем для не разветвленных молекул. Поэтому соединения с близкой молекулярной массой, но неодинаковым строением имеют различные температуры плавле ния (сравним, например, «-гептан и 2, 2, 3-триметилбу тан в таблице 10).
Взаимодействие между молекулами усиливается также с усложнением строения их электронных оболочек и увеличением полярности. Температуры плавления полярных веществ существенно выше температур плавления неполярных соединений. От полярности молекул сильно зависит растворимость молекулярных кристаллов. Большое значение при этом играет соотношение между размерами полярной и неполярной части молекул. Например, уксусная кислота Н3С—СООН смешивается с водой в любых отношениях, в то время как растворимость стеариновой кислоты составляет при 25°С всего лишь 0,03 г на 100 г Н2О.
Для соединений, молекулы которых имеют полярные группы О—Н, N—Н, S—Н, структура кристаллов определяется в основном энергией водородных связей и характером их расположения в пространстве. Наличием большого числа водородных связей
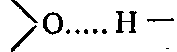
объясняется, в частности, своеобразная структура льда.
Поскольку каждая молекула воды имеет два атома водорода и две не поделенные пары электронов, она может образовать четыре водородные связи:

В изолированной молекуле воды расстояние между ядрами атомов водорода и кислорода составляет примерно 0, 096 нм, а угол между направлениями связей О — Н равен 105°. В твердом и жидком состояниях параметры молекул Н2О незначительно изменяются. В кристаллической решетке льда вследствие образования водородных связей угол НОН приближается к тетраэдрическому (109,5°), а расстояние между ядрами атомов водорода и кислорода увеличивается до 0,099 нм.
Кристаллы льда принадлежат к гексагональной системе. Каждая молекула воды связана водородными связями с четырьмя другими молекулами. Вследствие относительно большой длины этих связей упаковка молекул Н2О оказывается очень неплотной, в структуре льда на каждые 46 молекул воды приходится шесть пустот диаметром 0,59 нм и две пустоты диаметром 0,52 нм.
За счет включения в полости кристалла молекул хлора, аргона, ксенона и некоторых других газов возникают так называемые клатратные соединения или соединения включения. Их образование с последующим разрушением применяется для разделения углеводородов и некоторых других веществ. Клатраты используют также как удобную форму хранения газов.
Если внедряющиеся молекулы газа сравнительно невелики (Аr, Хе, СН4, СO2), то они занимают все восемь пустот. Образующиеся при этом клатраты имеют состав X•5,75Н2О (8:46= 1:5,75). Более крупные частицы занимает только шесть пустот. Предельное отношение числа внедренных молекул к числу молекул воды составляет в этом случае 6:46=1:7,67. Например, при охлаждении Хлорной воды выпадают кристаллы гидрата хлора, имеющие состав Сl2•8Н2O.
При атмосферном давлении лед плавится при 0°С. С точки зрения молекулярно-кинетической теории плавление льда происходит при такой температуре, когда энергия теплового движения молекул оказывается достаточной для разрыва большинства водородных связей. Тетраэдрическая структура льда разрушается, и вода переходит в жидкое состояние. В жидкой воде существует подвижное равновесие: действие водородных связей воссоздает в каждый момент времени в каждом элементе объема тетраэдрическую структуру льда, а тепловое движение молекул эту структуру разрушает.
Плавление льда сопровождается поглощением тепловой энергии в количестве 6,01 кдж/моль. Большая часть ее расходуется на разрыв водородных связей.
Решетка металлов
 Общее число валентных электронов атома металла недостаточно для образования обычных двухэлектронных связей со всеми ближайшими соседями в кристалле. Следовательно, связь атомов металла в кристаллической решетке имеет иную природу, чем ионная или ковалентная. С точки зрения современных представлений металл — это сложная система, состоящая из нейтральных атомов и положительно заряженных ионов, занимающих узлы кристаллической решетки, и «электронного газа», заполняющего межатомное пространство. В одних местах кристалла катионы захватывают электроны из окружающего пространства, превращаясь в нейтральные атомы, в других — атомы металла отдают свои валентные электроны и превращаются в катионы.
Общее число валентных электронов атома металла недостаточно для образования обычных двухэлектронных связей со всеми ближайшими соседями в кристалле. Следовательно, связь атомов металла в кристаллической решетке имеет иную природу, чем ионная или ковалентная. С точки зрения современных представлений металл — это сложная система, состоящая из нейтральных атомов и положительно заряженных ионов, занимающих узлы кристаллической решетки, и «электронного газа», заполняющего межатомное пространство. В одних местах кристалла катионы захватывают электроны из окружающего пространства, превращаясь в нейтральные атомы, в других — атомы металла отдают свои валентные электроны и превращаются в катионы.
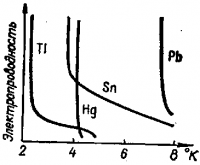
Рис. 5 . Изменение электропроводности металлов вблизи абсолютного нуля
Наличие «свободных» электронов в кристаллической решетке металла было подтверждено экспериментально опытами советских ученых Л. И. Мандельштама и Н. Д. Папалекси, которые наблюдали появление электрического тока при резком торможении вращающегося с большой скоростью куска металла. Ток возникает также при резком ускорении движения металлического тела (эффект Толмена). В последнем случае свободные электроны отбрасываются по инерции к противоположному по движению концу металла.
Одним из важнейших свойств металлов является их электропроводность. При одной и той же температуре одни металлы проводят электрический ток очень хорошо, другие — плохо. Величина электропроводности зависит от общего числа валентных электронов в атоме, степени за полнения отдельных энергетических подуровней и от типа кристаллической решетки:
Относительные значения электропроводности некоторых металлов
| Ag 59,0 | Na 20,8 | К 13,6 | Pt 9,7 | Be 5,2 | V 3,7 |
| Cu 56,9 | Ir 20,6 | Cd 12,6 | Pd 8,7 | Cr 5,1 | Hf 3,2 |
| Au 39,6 | Mo 20,0 | Ru 12,4 | Sn 8,3 | Cs 4,8 | Zr 2,3 |
| Al 36,1 | W 17,5 | Li 11,2 | Rb 7,7 | Nb 4,8 | Ti 2,2 |
| Ca 1,9 | Zn 16,0 | In 10,6 | Tl 6,3 | Pb 4,6 | Ba 1,9 |
| Rh 21,9 | Co 15,3 | Os 10,1 | Та 6,2 | Re 4,5 | Ce 1,2 |
| Mg 21,8 | Ni 13,9 | Fe 9,8 | Th 5,3 | Sr 4,2 | Hg 1,0 |
Для всех металлов характерно более или менее быстрое понижение электропроводности с увеличением температуры. Это объясняется усилением колебательного дви жения катионов и нейтральных атомов в узлах кристаллической решетки, что приводит к замедлению направленного перемещения свободных электронов под действием внешнего электрического поля. Очень интересным оказывается поведение металлов при низких температурах — вблизи абсолютного нуля (-273,16°С). Последовательно увеличиваясь с пониже нием температуры, электропроводность некоторых металлов, например свинца , олова, ртути, неожиданно возрастает практи чески до бесконечности (Рис. 5).
Это явление получило название сверхпроводимости. Оно характерно также для ряда сплавов и соединений металлов: карбидов, нитридов и т. д.
Статья на тему Кристаллические решетки
Кристаллическое строение металлов. Кристаллическая решетка металлов. Металлы в периодической системе Менделеева
От DA
Из школьного курса химии известно, что все элементы, которые сгруппированы по определенным правилам в периодическую таблицу Менделеева, можно условно разделить на металлы и неметаллы. В этой статье будет рассказано о кристаллическом строении металлов, их физико-химических свойствах, а также о дефектах на атомном уровне, которые в них присутствуют.
Периодическая таблица и металлы
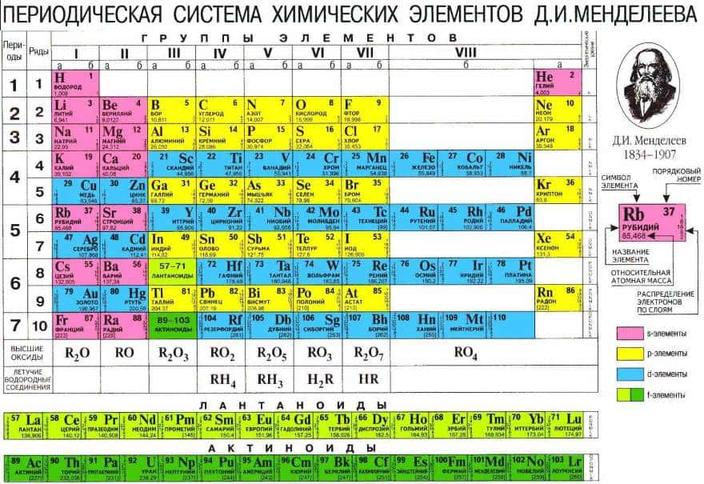
В XIX веке благодаря своему блестящему уму и многим годам труда Дмитрий Иванович Менделеев составил таблицу, собрав в нее все известные на то время химические элементы. Каждому из них в таблице отведено определенное положение в соответствии с числом протонов в атомном ядре. Вся таблица делится на 7 периодов (горизонтальные строки) и 8 групп (вертикальные строки). Чем больше период, тем больше радиус атома соответствующего элемента, и тем на более высоких орбиталях расположены его валентные электроны. Наоборот, чем старше группа (движение по таблице слева направо), тем больше валентных электронов находится на последней орбитали и тем меньше радиус атома.
Любой элемент таблицы можно условно отнести либо к металлам, либо к неметаллам. Металлы расположены по левую сторону от диагонали бор (B) — полоний (Po). Если взглянуть на таблицу, то можно сразу понять, что количество металлов в несколько раз превышает число неметаллов.
Что такое металл и чем он отличается от неметалла?
Иными словами, как можно понять, что перед нами находится металлический материал? Ответы на все эти вопросы можно получить, если рассмотреть уникальные свойства металлов. К ним относятся следующие основные:
- Наличие металлического блеска при полировке поверхности. Все металлы блестят, в своем большинстве они имеют серый цвет, однако, некоторые металлы обладают специфической окраской, например, висмут розовый, медь красноватая, а золото желтое.
- Высокая теплопроводность и электропроводность. При комнатной температуре наиболее высокие показатели для этих физических свойств характерны для меди и серебра.
- При комнатной температуре практически все металлы находятся в твердом агрегатном состоянии материи. Исключение составляет ртуть, которая плавится уже при -39 oC.
- Будучи в твердом состоянии, металлы кристаллическим строением характеризуются. Если расплав рассматриваемого материала слишком быстро охлаждать, то он приобретает аморфную структуру, в которой все же сохраняется ближний порядок.
- Температуры плавления и плотности металлов варьируются в широких пределах. Так, элемент вольфрам является самым тугоплавким (3410 oC). Самым же тяжелым считается осмий (в 22,6 раза плотнее воды), а самым легким — литий (почти в 2 раза менее плотный, чем вода).
- Все металлы химически активны. Поскольку они обладают низкой электроотрицательностью, то в химических реакциях их атомы отдают электроны и превращаются в положительно заряженные ионы (катионы).

Выше в списке были перечислены основные свойства металлов, которые их отличают от неметаллических материалов. Примерами последних являются кислород, азот, благородные газы, сера, кремний, углерод и некоторые другие. Заметим, что все живые организмы состоят в основном из неметаллов.
Какие металлы бывают?
Металлы в периодической системе Менделеева делятся на несколько групп. Перечислим и кратко охарактеризуем их:
- Щелочные. Эти металлы имеют всего 1 валентный электрон, они чрезвычайно химически активны, имеют низкую плотность и являются отличными проводниками тепла и электричества. Примерами их являются литий, натрий и калий.
- Щелочноземельные. К ним относятся кальций, магний, стронций. Эти металлы имеют 2 валентных электрона, поэтому они также являются химически активными.
- Переходные. Это металлы с переменной валентностью, которые имеют пустые или полупустые орбитали d и f типа. Это самая многочисленная группа металлов. К ним относятся титан, ванадий, хром, никель, вольфрам, осмий, золото и многие другие.
- Лантаноиды и актиноиды. Большая часть этих элементов является нестабильными и проявляет различную степень радиоактивности.
- Постпереходные. Это те элементы, после которых по периоду идут металлоиды, а затем неметаллы. Самыми известными из них являются свинец, алюминий и олово.
Черные и цветные металлы
Выше была приведена классификация рассматриваемых элементов в соответствии с их электронным строением и положением в периодической системе. Помимо нее, существует еще одно разделение, которое не связано с атомным строением — это понятие о черных и цветных металлах.
Черным является железо и все сплавы с его участием. Примеры цветных металлов — это алюминий, золото, серебро, медь и другие, а также сплавы, которые не содержат железа. Причина такого разделения проста, черные металлы являются дешевыми и недолговечными (разрушаются в результате коррозии, ржавеют). Наоборот, цветные металлы характеризуются способностью образовывать пленки оксидные, которые предотвращают основную массу материала от дальнейшего химического разрушения.
Металлическая связь
Изучая атомно-кристаллическое строение металлов, следует сказать несколько слов об особенностях химической связи между рассматриваемыми элементами. Поскольку электроотрицательность металлов низкая, то, объединяясь в кристаллическую решетку, каждый атом отдает один или несколько валентных электронов. Эти электроны слабо связаны с ядром, поэтому они легко от него отрываются уже при комнатных температурах.
Совокупность валентных электронов, которые свободно движутся в пространстве между ионными остовами в кристаллической решетке металлов, называется электронным газом. Благодаря ему кусок металла легко проводит тепло и электричество.
Электрическое поле положительно заряженных ионных остовов компенсируется отрицательным полем "размазанного" по объему металла электронного газа. Такая связь называется металлической. Она кардинальным образом отличается от других типов химической связи. Например, в ковалентной атомы не отдают электроны в межатомное пространство, они становятся общими только для двух атомов. Наоборот, в ионной связи один атом полностью лишает второго валентных электронов, присоединяя их к себе, и приобретая отрицательный заряд.
Кристаллическое строение металлов. Типы кристаллических решеток
Когда металл образует твердую структуру, то все его атомы стремятся занять такие положения в пространстве относительно друг друга, чтобы они соответствовали минимуму потенциальной энергии. Этому минимуму соответствует кристаллическая решетка.
Под кристаллической решеткой понимают такую пространственную атомную структуру, которая может быть получена, если известны координаты ограниченного числа ее атомов и вектора их трансляции в пространстве. Указанное число атомов называется базисом решетки, а их положения образуют так называемую элементарную ячейку.
Все металлы кристаллизуются в трех основных типах решеток:
- гранецентрированная кубическая (ГЦК);
- объемно-центрированная кубическая (ОЦК);
- гексагональная плотноупакованная (ГПУ).
Благодаря кристаллическому строению металлы обладают такими свойствами, как пластичностью, упругостью и металлическим блеском.
Решетки ГЦК, ОЦК, ГПУ
Изучая кристаллическое строение металлов, охарактеризуем подробнее каждый тип кристаллической решетки. Начнем с ГЦК. Она показана ниже на рисунке.
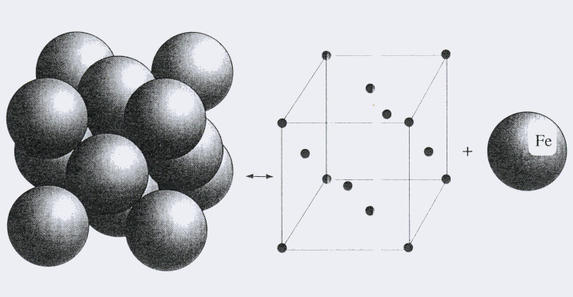
Как видно, это решетка представляет собой кубик, в котором атомы расположены в его вершинах и в центрах всех шести граней. Применяя методы кристаллографии, несложно показать, что для получения такой решетки в пространстве достаточно всего четырех атомов и векторов трансляций, совпадающих с ребрами куба.
Примерами металлов, которые кристаллизуются в ГЦК, являются алюминий, медь, золото и серебро. Железо образует ГЦК решетку только при высоких температурах.
ОЦК решетка показана ниже.
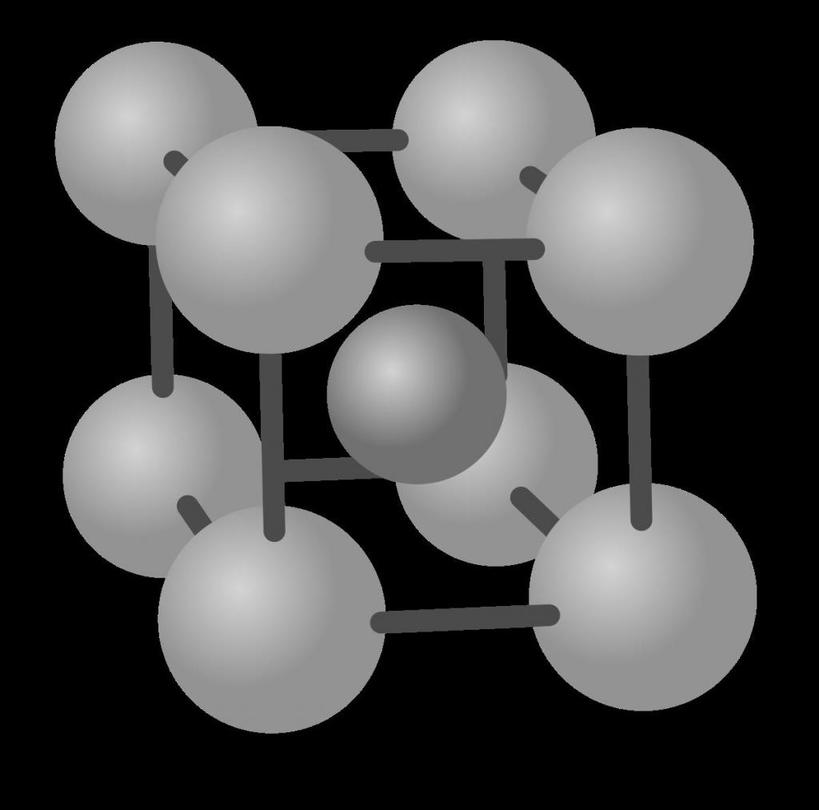
Мы видим, что она соответствует кубику, в вершинах и в центре которого находится атом. Всего два атома необходимо, чтобы в прямоугольных декартовых координатах построить ОЦК решетку. Такие металлы, как ванадий, тантал, ниобий, вольфрам имеют именно эту кристаллическую структуру.
Наконец, ГПУ решетка. Она представлена ниже на рисунке.
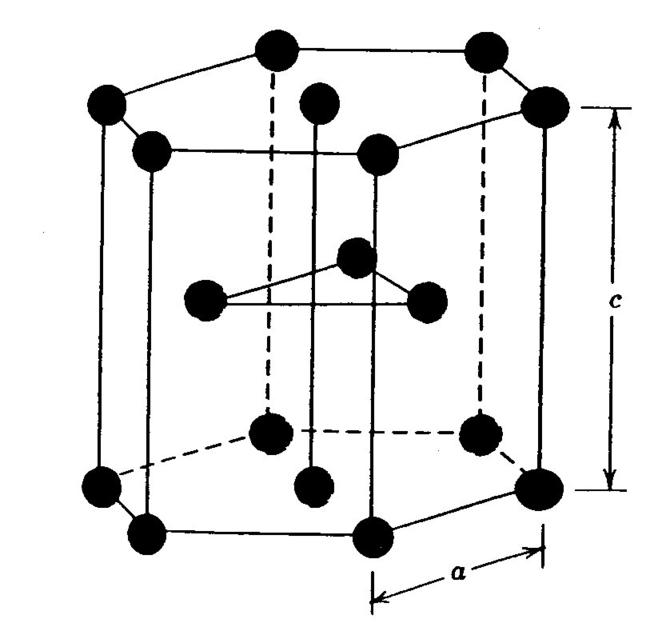
Эта кристаллическая решетка металлов отличается от двух предыдущих тем, что она в пространстве образует не куб, а правильную шестиугольную призму, которая состоит из шести атомов. В данной структуре кристаллизуются такие элементы, как титан, цирконий, магний и кобальт.
Понятие об индексах Миллера
Чтобы удобно было описывать численно показанные выше пространственные решетки, в кристаллографии используют так называемые индексы Миллера. Они представляют собой наборы чисел, которые позволяют точно определить положение в пространстве данного атомного ряда или атомной плоскости. По этим числам судят о поверхностных энергиях, о способности металлов проявлять пластические свойства. Например, в ГЦК решетке краевые дислокации движутся по плоскостям (1,1,1) (эти плоскости являются максимально плотноупакованными, нормалью к ним будут диагонали куба).
Дефекты в металлах
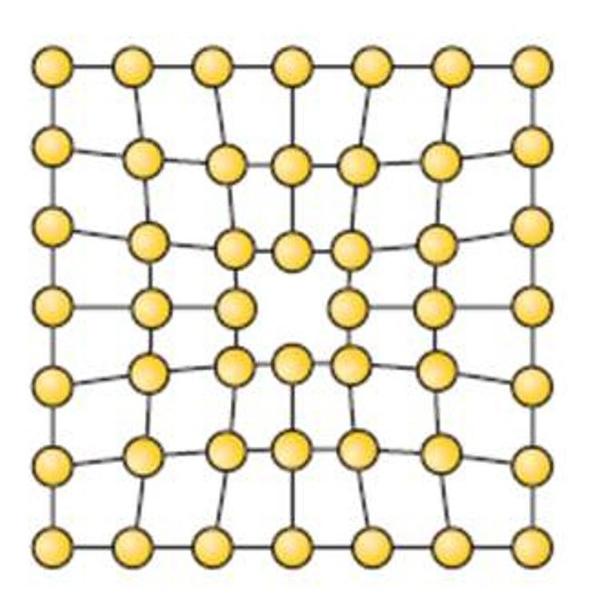
Выше мы показали идеальную ситуацию, когда все атомы находятся на своих местах, и пространственную структуру всего металлического куска можно получить с помощью простых трансляций элементарной ячейки. В действительности же существуют множество несовершенств кристаллического строения металлов. Они называются дефектами.
Все дефекты можно по геометрическому признаку отнести к одному из четырех типов:
- Точечные. Вакансии, межузельные атомы, наличие внедренных атомов других элементов, создающих микроскопические локальные напряжения.
- Линейные. Дислокации — обрывы кристаллических плоскостей, которые обеспечивают пластичность всех металлов.
- Плоские — границы зерен. Любой металл состоит из множества монокристаллов, которые друг с другом соединены в различной ориентации через межзеренные границы.
- Объемные. Поры, различные фазовые включения, которые упрочняют металл и снижают его пластичность.
Влияние дефектов на свойства
Как правило, дефекты кристаллического строения металлов приводят к снижению их теплопроводности и электропроводности, материал становится более прочным и менее пластичным. Ярким примером является сталь, которая за счет междоузельных атомов углерода и наличия разных фаз (цементита, графита) в кристаллической решетке железа, значительно прочнее, чем чистый металл.
С развитием нанотехнологий влияние дефектов на свойства металлов может быть неоднозначным. Так, с уменьшением размера зерна может наблюдаться увеличение пластичности материала, что связано с появлением совершенно иного механизма пластической деформации — зернограничного проскальзывания, которое по своей сути отличается от дислокационного.
Реальный кристалл металла
Какой бы химический металлический элемент не рассматривался, в действительности он представляет собой твердое вещество, в котором маленькие монокристаллы (зерна) соединены друг с другом в различных ориентациях. Такая структура образует поликристалл. В нем, помимо границ зерен, присутствуют дефекты всех четырех типов, включая примеси таких неметаллов, как кислород, азот и водород. Последний из-за своих размеров легко проникает в любую кристаллическую решетку, образует с ее ионами твердые фазы, которые приводят к охрупчиванию металла, что является одной из актуальных проблем металловедения.
Металлы — кристаллические тела, атомы которых располaгaются в геометрически правилъном порядке, образуя кристаллы, в отличие от аморфных тел (например, смола), атомы которых находятся в беспорядочном состоянии.
Располагаясь в металлах в строгом nopядкe, атомы в плоскости образуют атомную сетку, а в пространстве — атомно-кристаллическую решeтку.
Типы кристаллических решеток у различных металлов различные. Наиболее часто встречаются решетки: кубическая – объемно-центрированная, кубическая гранецентрированная и гексагональная плотноупакованная.

Элементарные ячейки таких кристаллических решеток приведены на рис. l.5. В ячейке решетки кубической объемноцетрированной атомы расположены в вершинах куба и в центре куба; такую решетку имеют хром, ванадий, вольфрам, молибден и др. В ячейке кубической гранецентрированной решетки атомы расположены в вершинах и в центре каждой грани куба; такую решетку имеют алюминий, никель, медь, свинец и др. В ячейке гексагональной решетки атомы расположены в вершинах шестиугольных оснований призмы, в центре этих оснований и внугри призмы; гексагональную решетку имеют магний, титан, цинк и др. В реальном металле кристаллическая решетка состоит из огромного количества ячеек.
Размеры кристаллической решетки характеризуются ее параметрами, измеряемыми в ангстремах — Ã (1Ã = 10 -8 см или 1 Ã = 0,1 Нм). Параметр кубической решетки характеризуется длиной ребра куба, обозначается буквой а и находится в пределах 0,28 — 0,6 Нм (2,8 — 6 Ã). Для характеристики гексагональной решетки принимают два параметра — сторону шестигранника а и высоту призмы с. Когда отношение с!а = 1,633,то атомы упакованы наиболее плотно, и поэтому такая решетка называется гексагональной плотноупакованной. .
В различных плоскостях кристаллической решетки атомы расположены с различной плотностью и поэтому многие свойства кристаллов в различных направлениях различны. Такое различие называетсяанизотропией. Все кристаллы анизотропны. В отличие от кристаплов аморфные тела (например, смола) в различных направлениях имеют в основном одинаковую плотность атомов и, следовательно, одинаковые свойства, т. е. они изотропны.
Степень анизотропности может быть значительной. Исследования монокристалла (единичного кристалла) меди в различных направлениях показали, что предел прочности σв изменяется от 120 ДО 360 МН/м 2 (от 12 до 36 кгc/мм 2 ), а удлинение δ от 10 до 55%.
В металлах, состоящих из большого количества по-разному ориентированных мелких анизотропных кристаллов (поликристалл), свойства во всех направлениях одинаковы (усредненные). Эта кажущаяся независимость свойств от направления называется – квазиизотропией (приставка «квази» означает по латыни мнимый).
Если в структуре металла создается одинаковая ориентировка кристаллов, то появляется анизотропия.
Кристаллизация металлов.
При переходе металла из жидкого состояния в твердое происходит так называемый процесс крисмаллизации.
Основы теории кристаллизации разработаны основоположником науки о металлах — металловедения Д. К. Черновым, который установил, что кристаллизация состоит из двух процессов:
зарождения мельчайших частиц кристаллов (зародышей или «центров» кристаллизации) и роста кристаллов из этих центров (рис. 1.6.)


Рост кристаллов заключается в том, что к их зародышам присоединяются все новые атомы жидкого металла. Сначала кристаллы растут свободно, сохраняя правильную геометрическую форму, но это происходит только до момента встречи растущих кристаллов в месте соприкосновения кристаллов рост отдельных их граней прекращается, и развиваются не все, а только некоторые грани кристаллов. В результате кристаллы не имеют правильной геометрической формы. Такие кристаллы называют кристаллитами, или зернами. Величина зерен зависит от числа центров кристаллизации и скорости роста кристаллов. Чем больше центров кристаллизации, тем больше образуется в данном объеме и каждый кристалл (зерно) меньше.
Рис.1.7. Влияние скорости охлаждения на возникновение центров кристаллизации и на величину образующих зерен: 1 – медленное охлаждение; 2 — ускоренное охлаждение; 3 — быстрое охлаждение.
На образование центров кристаллизации влияет скорость охлаждения. Чем больше скорость охлаждения металла, тем больше возникает в нем центров кристаллизации, и зерна получаются мельче (рис. l.7.) Это подтверждается на практике в тонких сечениях литых деталей, охлаждающихся более быстро, металл всегда получается более мелкозернистым, чем в толстых массивных литых деталях, охлаждающихся медленнее.
Методом получения мелкого зерна при затвердевании металла является создание искусственных центров кристаллизации. Для этого в расплавленный металл вводят специальные вещества, называемые модификаторами; процесс искусственного регулирования размеров зерен получил название модифицирования.

Форма растущих кристаллов определяется не только условиями их столкновений между собой, но и составом сплава, наличием примесей и условиями охлаждения. В большинстве случаев при кристаллизации металлов механизм образования носит так называемый дендритный характер.
Дендритная кристаллизация характеризуется тем, что рост зародышей происходит с неравномерной скоростью. После образования зародышей их развитие идет главным образом в тех направлениях решетки; которые имеют наибольшую плотность упаковки атомов (минимальное межатомное расстояние).
В этих направлениях образуются длинные ветви будущего кристалла – так называемые оси первого порядка (1 на рис. 1.8.).
В дальнейшем от осей первого порядка под определенными углами начинают расти новые оси, которые называют осями второго порядка (2), от осей второго порядка растут оси третьего порядка (3) и т. д.
По мере кристаллизации образуются оси более высокого порядка (четвертого, пятого, шестого и т. д.), которые постепенно заполняют все промежутки, ранее занятые жидким металлом.
В условиях, при которых не хватает жидкого металла для заполнения пространства между осями, например, при затвердевании последних объемов слитком, дендритное строение выявляется весьма отчетливо рис. 1.8.
Последнее изменение этой страницы: 2016-12-16; Нарушение авторского права страницы



Отправить ответ