Промышленный способ получения ацетилена
Содержание:
Характеристики и физические свойства ацетилена
Мало растворим в воде и очень хорошо в ацетоне. В виде ацетонового раствора его хранят в стальных баллонах, заполненных каким-нибудь инертным пористым материалом. Смеси ацетилена с воздухом взрывоопасны.
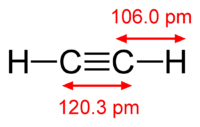
Рис. 1. Строение молекулы ацетилена.
Таблица 1. Физические свойства ацетилена.
Молярная масса, г/моль
Температура плавления, o С
Температура кипения, o С
Получение ацетилена
Выделяют промышленные и лабораторные способы получения ацетилена. Так, в промышленности ацетилен получают путем высокотемпературного крекинга метана:
В лаборатории ацетилен получают гидролизом карбида кальция:
Кроме вышеперечисленных реакций, для получения ацетилена используют реакции дегидрирования алканов и алкенов:
Химические свойства ацетилена
Ацетилен вступает в реакции присоединения, протекающие по нуклеофильному механизму, такие как:
Кроме этого ацетилен способен образовывать соли при взаимодействии с активными металлами (1) и оксидом серебра (2):
2СH≡CH +2Na→2 СH≡C-Na + H2 (1);
Он способен тримеризоваться:
Применение ацетилена
Ацетилен является исходным продуктом для многих важнейших химических производств. Например, из ацетилена получают различные галогенпроизводные, такие как тетрахлорэтан и трихлорэтилен, являющиеся хорошими растворителями, а также винилхлорид, служащий мономером для получения поливинилхлорида. Кроме этого ацетилен используется для получения синтетических каучуков.
Примеры решения задач
| Задание | Эквимолекулярная смесь ацетилена и формальдегида полностью реагирует с 69,6 г Ag2O, растворенного в аммиаке. Определите состав исходной смеси. |
| Решение | Запишем уравнения реакций, указанных в условии задачи: |
Рассчитаем количество вещества оксида серебра (I):
n(Ag2O) = 69,6 / 232 = 0,3 моль.
По уравнению (2) количество вещества формальдегида будет равно 0,1 моль. По условию задачи смесь эквимолекулярна, следовательно, ацетилена тоже будет 0,1 моль.
Найдем массы веществ, составляющих смесь:
M(HC≡CH) = 26 г/моль;
M(H-C(O)H) = 30 г/моль;
m(HC≡CH) = 0,1 × 26 = 2,6 г;
m(H-C(O)H) = 0,1 × 30 = 3 г.
| Задание | При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси. |
| Решение | При пропускании смеси пропана и ацетилена через склянку с бромной водой происходит поглощение ацетилена. Запишем уравнение химической реакции, соответствующее этому процессу: |
Таким образом, значение, на которое увеличилась масса склянки (1,3 г) представляет собой массу ацетилена. Найдем количество вещества ацетилена (молярная масса – 26 г/моль):
Запишем уравнение реакции сгоранияацетилена:
Согласно уравнению реакции, в неё вступило 2 моль ацетилена, однако, известно, что 0,05 моль из этого количества поглотилось бромной водой. Т.е. выделилось:
Найдем общее количество оксида углерода (IV):
Запишем уравнение реакции сгорания пропана:
Учитывая, что в реакции сгорания ацетилена выделилось 0,1 моль оксида углерода (IV), количество вещества оксида углерода (IV), выделившееся в ходе сгорания пропана равно:
0,625 — 0,1 = 0,525 моль СО2.
Найдем количество вещества пропана, вступившего в реакцию горения. Согласно уравнению реакции n(CO2) : n(С3Н8) = 3 : 1, т.е.
Вычислим массу пропана (молярная масса 44 г/моль):
Тогда, общая масса смеси углеводородов составит:
Ацетилен – это один из наиболее значимых углеводородов с тройной связью. Он является первым представителем ряда ацетилена, а также бесцветным газом, который практически не растворим в воде. Молекула ацетилена имеет на два атома водорода меньше, чем в молекуле этилена, и при этом характерно образование третьей связи между атомами углерода.
1) может применяться в качестве горючего при газовой сварке и резке металлов;
2) используется также для синтеза различных органических соединений;
3) в результате присоединения хлора к ацетилену получают растворитель – 1,1,2,2-тетрахлорэтан. Путем дальнейшей переработки тетрахлорэтана получаются другие хлорпроизводные;
4) при отщеплении хлороводорода от 1,1,2,2-тетрахлорэтана образуется трихлорэтен – растворитель высокого качества, который широко применяется при чистке одежды: СНСI = ССI2;
5) в больших количествах ацетилен идет на производство хлорэтена, или винилхлорида, с помощью полимеризации которого получается поливинилхлорид (используется для изоляции проводов, изготовления плащей, искусственной кожи, труб и других продуктов);
6) из ацетилена получаются и другие полимеры, которые необходимы в производстве пластмасс, каучуков и синтетических волокон.
1) в лабораториях и промышленности ацетилен чаще всего получается карбидным способом. Если кусочки карбида кальция поместить в сосуд с водой или если воду добавлять к карбиду кальция, начинается сильное выделение ацетилена: СаС2 + 2НОН → С2Н2 + Са(ОН)2. Со стороны промышленности полимерных материалов карбидный способ является малоэффективным. Он связан с большими затратами электроэнергии на получение карбида кальция.
Особенности карбида кальция:
а) карбид кальция получают в электропечах;
б) получается при взаимодействии извести с углеродом (коксом, антрацитом);
в) получается при температуре 2000 °C: СаО + 3С → СаС2 + СО;
2) применяется способ получения ацетилена из более доступного химического сырья – природного газа (метана).
Особенности получения ацетилена из метана: а) если метан нагревать до высокой температуры, то он разлагается на углерод и водород; б) одним из промежуточных продуктов этой реакции становится ацетилен: 2СН4 → 2С + 4Н2;
в) одной из характерных черт получения ацетилена из метана являются две идеи:
– выделить его на промежуточной стадии;
– не дать ацетилену возможности разложиться на углерод и водород.
Для этого образующийся ацетилен необходимо быстро удалить из зоны высокой температуры и охладить.
24. Диеновые углеводороды
Строение и номенклатура.
Диеновые углеводороды – это углеводороды с двумя двойными связями.
Общая формула диеновых углеводородов: СnН2n-2.
Алкадиены, в молекулах которых две двойных связи разделены одной простой связью, называются соединениями с сопряженными двойными связями (дивинил и его гомологи).
Алкадиены, в молекулах которых две двойных связи примыкают к одному углеродному атому, называются углеводородами с кумулированными двойными связями (аллен и его гомологи):
R-СН =С=СН2 алкилаллены.
Углеводороды, в молекулах которых две двойных связи разделены двумя и более простыми связями, называются алкадиенами с изолированными двойными связями.
Химические свойства диеновых углеводородов.
Имея двойные связи в молекулах, диеновые углеводороды вступают в обычные реакции присоединения.
Например: а) обесцвечивают бромную воду; б) присоединяют галогеноводороды.
Характерной особенностью реакции присоединения является то, что наряду с обычным 1,2-присоединением идет 1,4-присоединение, при этом между 2-м и 3-м углеродными атомами возникает двойная связь. При реакции бутадиена-1,3 с бромистым водородом получается два продукта:

Соотношение продуктов реакции зависит от температуры и природы галогена. Выход продукта 1,4-присоединения увеличивается с повышением температуры и при переходе от хлора к йоду. При комнатной температуре получают смесь продуктов 1,2– и 1,4-присоединения. При низких температурах образуется больше того продукта, скорость образования которого выше (кинетически контролируемый продукт 1,2-присоединения). При высоких температурах образуется термодинамически более стабильный продукт 1,4-присоединения (термодинамически контролируемый продукт реакции). При наличии достаточного количества брома молекула бутадиена может присоединить по месту образующейся двойной связи еще одну молекулу галогена. При наличии двойных связей диеновые углеводороды довольно легко полимеризуются.
Продуктом полимеризации 2-метилбутадиена-1,3 (изопрена) является природный каучук.

Ацетилен – химически инертный, но чрезвычайно взрывоопасный газ, получил широкое производственное применение благодаря своей уникальной способности образовывать с смеси с кислородом пламя чрезвычайно высокой температуры, которая достигает 3150 С. Оно способно локально расплавлять практически все тугоплавкие металлы и сплавы (за исключением вольфрама). Не менее полезен ацетилен и в сфере промышленного органического синтеза, где этот газ с успехом применяется при производстве синтетического каучука, уксусной кислоты и пр.
История открытия ацетилена
В первой половине XIX века химия уже вплотную подошла к решению проблемы получения органических веществ из неорганических. Одним из разносторонних учёных той эпохи можно назвать и француза Марселена Бертло. Преимущественно Бертло занимался химией, но известно почти 3000 написанных им работ и в других отраслях человеческих знаний — археологии, философии, истории. Именно Бертло и удалось впервые синтезировать ацетилен из простых составляющих – водорода и углерода. Опыт, считающийся сейчас элементарным, чуть не стоил французскому химику здоровья: когда он сквозь зажжённые угольные стержни начал продувать водородную струю, его рука лишь по счастливой случайности не была обожжена сильной струёй светло-голубого горючего газа, который образовался в результате такой продувки. Теперь любой школьник легко выведет формулу химической реакции, инициированной М. Бертло в 1862 году:
Впрочем, из-за опасности подобного способа, для получения ацетилена начали использовать другой метод. Он был сложнее, но зато значительно безопаснее. Процесс состоял из двух этапов:
1. Высокотемпературного сплавления окиси кальция с коксом – промежуточным продуктом получения железной руды, в результате чего образовывался карбид кальция – вещество и сейчас применяемое для производства газовой сварки и резки:
СаО + 3С = СаС2 + СО
2. Гидратированием получившегося карбида с образованием ацетилена и малорастворимого в воде гидрата окиси кальция:
СаС2 + 2Н2О = С2Н2 + Са(ОН)2
Впервые такой опыт получения ацетилена в сравнительно больших количествах был успешно проведен в 1896 году немецким инженером Э. Виссом.
Современные способы получения ацетилена
К началу ХХ века стало ясно, что карбидный метод промышленного получения ацетилена обладает существенным недостатком: он оказался весьма энергозатратным (в частности, на 1 кг ацетилена необходимо затратить до 11000 квт∙ч электроэнергии). Естественно, что бурно развивавшаяся промышленность не могла себе этого позволить. Хотя в небольших масштабах такой способ получения ацетилена используется и в наше время, для производства этого газа в больших количествах изобретены более прогрессивные методы.
Среди них:
• Использование явления пиролиза кокса, получаемого в электрометаллургических печах (способ получил особенное развитие в странах, где преобладающим методом выплавки стали является электрометаллургия, например, во Франции). По сути, это тот же метод Висса, но адаптированный под электрометаллургический кокс. Следует отметить, что получение высокоэффективных карбидных печей до сих пор не вышло из стадии экспериментальных разработок;
• Пиролиз лёгких углеводородов – метана, бутана, пропана. лёгких бензиновых фракций и т.д. – в процессе их внешнего подогрева или даже сгорания в условиях протекания дугового разряда. Этот метод, названный его изобретателем, белорусским учёным Н. Печуро, методом электрокрекинга, широко используется в нашей стране и там, где имеется масштабное промышленное производство углеводородов;
• Термическое высокотемпературное разложение газообразных углеводородов с использованием кислородных горелок. Преимущество данного способа заключается в том, что высокотемпературная плазма малочувствительна к качеству исходного сырья. Поэтому для получения ацетилена можно использовать малоценные углеводороды или их отходы.
Следует отметить, что во всех из представленных способов выход ацетилена достаточно велик, и составляет от 98%.
Первой промышленной установкой для производства ацетилена в больших объёмах принято считать реактор в производственно-исследовательском центре Оппау (Германия, 1942 г). Промышленность Третьего Рейха, испытывая острый недостаток в природных углеводородах, активно синтезировала коксовый и светильный газ Саарского каменноугольного бассейна, который и использовался для производства ацетилена. Тогда же началось более-менее масштабное производство сжиженного ацетилена.
В настоящее время с целью обеспечения надлежащей безопасности хранение и транспортировка сжиженного ацетилена выполняется с его предварительным растворением в ацетоне, а для перевозки применяют баллоны, размещаемые в толще мягких пористых веществ, минимизирующих риски в случае внезапной разгерметизации баллонов.
Ввиду высокой взрывоопасности данного газа, разработаны и используются следующие приёмы повышения безопасности работ с ацетиленом:
1. Применение ацетиленовых генераторов пониженного объёма, в управляющей цепи которых исключаются серебро и медь — химические элементы, при взаимодействии с которыми образуется чрезвычайно взрывоопасная смесь.
2. Разбавление ацетилена химически инертными газами (например, азотом) или их парами, которые воспринимают на себя часть тепла, выделяемого ацетиленом, и тем самым снижают его быстрое разложение, впоследствии приводящее к взрыву.
3. Ограничение давления ацетилена безопасной границей в 0,2 МПа.
4. Использование ацетиленовых генераторов с низкой скоростью перемещения подвижных узлов, с тем, чтобы температура в рабочем пространстве машины не превышала 1000С.
5. Дополнительная установка в схемах установок, использующих ацетилен, предохранительных устройств, а также преградителей распространения пламени (шариковых клапанов, гидрозатворов и т.д.).
Интересные факты, связанные с применением ацетилена
• Ацетилен занимает первое место среди газов по своей способности к локальному разогреву металла и концентрации тепловой мощности в зоне ацетиленовой струи. При этом не только снижается трудоёмкость производства разделительных операций с применением ацетиленовых генераторов, но и существенно улучшается качество поверхности реза: кромки получаются наиболее чистыми и ровными, а разделение металла может выполняться под какими угодно углами;
• Ацетилен можно применять также и для целей пайки абсолютно разнородных между собой материалов: с этой целью ацетиленовую струю вдувают между твёрдыми припоями;
• Для сохранения фруктов, транспортируемых к потребителю на весьма далёкие расстояния (в частности, бананов, ананасов и т.д.) их собирают немного незрелыми, а при перевозке помещают в ацетиленовую среду. Небольшое стравливание ацетилена в емкость с плодами обеспечивает их постепенное дозревание;
• В стекольной промышленности ацетилен применяют для предотвращения образования пузырьков. Для этого формы, используемые для выдувания стеклянных изделий, обрабатывают ацетиленом;
• Впервые кислородно-ацетиленовый резак был использован…взломщиками банка в немецком Ганновере в 1901 году. Преступникам удалось незаметно пронести в помещение компактный баллон с кислородом и ацетиленом. Однако толщина стального сейфа оказалась неприступной: из-за большого расхода кислорода, его не хватило, и взломщикам удалось пройти только 8 мм стального листа.
Компания DP Air Gas – крупнейший поставщик сжиженных газов по территории СНГ, а также некоторых стран ближнего зарубежья. Располагая современной техникой и оборудованием для производства и перевозки сжиженных газов, DP Air Gas всегда гарантирует своевременную и качественную доставку технических газов и их смесей. Технология транспортировки сжиженных газов постоянно совершенствуется, как в плане возможных утечек сырья, так и для повышения безопасности транспортируемых продуктов. Компания использует разнообразные пути доставки товара своим клиентам: автомобильным, речным и морским транспортом. Возможна аренда ёмкостей, а также специализированных транспортных средств для доставки сжиженных газов.



Отправить ответ