Схема металлической кристаллической решетки
Содержание:
Металлы — кристаллические тела, атомы которых располaгaются в геометрически правилъном порядке, образуя кристаллы, в отличие от аморфных тел (например, смола), атомы которых находятся в беспорядочном состоянии.
Располагаясь в металлах в строгом nopядкe, атомы в плоскости образуют атомную сетку, а в пространстве — атомно-кристаллическую решeтку.
Типы кристаллических решеток у различных металлов различные. Наиболее часто встречаются решетки: кубическая – объемно-центрированная, кубическая гранецентрированная и гексагональная плотноупакованная.

Элементарные ячейки таких кристаллических решеток приведены на рис. l.5. В ячейке решетки кубической объемноцетрированной атомы расположены в вершинах куба и в центре куба; такую решетку имеют хром, ванадий, вольфрам, молибден и др. В ячейке кубической гранецентрированной решетки атомы расположены в вершинах и в центре каждой грани куба; такую решетку имеют алюминий, никель, медь, свинец и др. В ячейке гексагональной решетки атомы расположены в вершинах шестиугольных оснований призмы, в центре этих оснований и внугри призмы; гексагональную решетку имеют магний, титан, цинк и др. В реальном металле кристаллическая решетка состоит из огромного количества ячеек.
Размеры кристаллической решетки характеризуются ее параметрами, измеряемыми в ангстремах — Ã (1Ã = 10 -8 см или 1 Ã = 0,1 Нм). Параметр кубической решетки характеризуется длиной ребра куба, обозначается буквой а и находится в пределах 0,28 — 0,6 Нм (2,8 — 6 Ã). Для характеристики гексагональной решетки принимают два параметра — сторону шестигранника а и высоту призмы с. Когда отношение с!а = 1,633,то атомы упакованы наиболее плотно, и поэтому такая решетка называется гексагональной плотноупакованной. .
В различных плоскостях кристаллической решетки атомы расположены с различной плотностью и поэтому многие свойства кристаллов в различных направлениях различны. Такое различие называетсяанизотропией. Все кристаллы анизотропны. В отличие от кристаплов аморфные тела (например, смола) в различных направлениях имеют в основном одинаковую плотность атомов и, следовательно, одинаковые свойства, т. е. они изотропны.
Степень анизотропности может быть значительной. Исследования монокристалла (единичного кристалла) меди в различных направлениях показали, что предел прочности σв изменяется от 120 ДО 360 МН/м 2 (от 12 до 36 кгc/мм 2 ), а удлинение δ от 10 до 55%.
В металлах, состоящих из большого количества по-разному ориентированных мелких анизотропных кристаллов (поликристалл), свойства во всех направлениях одинаковы (усредненные). Эта кажущаяся независимость свойств от направления называется – квазиизотропией (приставка «квази» означает по латыни мнимый).
Если в структуре металла создается одинаковая ориентировка кристаллов, то появляется анизотропия.
Кристаллизация металлов.
При переходе металла из жидкого состояния в твердое происходит так называемый процесс крисмаллизации.
Основы теории кристаллизации разработаны основоположником науки о металлах — металловедения Д. К. Черновым, который установил, что кристаллизация состоит из двух процессов:
зарождения мельчайших частиц кристаллов (зародышей или «центров» кристаллизации) и роста кристаллов из этих центров (рис. 1.6.)


Рост кристаллов заключается в том, что к их зародышам присоединяются все новые атомы жидкого металла. Сначала кристаллы растут свободно, сохраняя правильную геометрическую форму, но это происходит только до момента встречи растущих кристаллов в месте соприкосновения кристаллов рост отдельных их граней прекращается, и развиваются не все, а только некоторые грани кристаллов. В результате кристаллы не имеют правильной геометрической формы. Такие кристаллы называют кристаллитами, или зернами. Величина зерен зависит от числа центров кристаллизации и скорости роста кристаллов. Чем больше центров кристаллизации, тем больше образуется в данном объеме и каждый кристалл (зерно) меньше.
Рис.1.7. Влияние скорости охлаждения на возникновение центров кристаллизации и на величину образующих зерен: 1 – медленное охлаждение; 2 — ускоренное охлаждение; 3 — быстрое охлаждение.
На образование центров кристаллизации влияет скорость охлаждения. Чем больше скорость охлаждения металла, тем больше возникает в нем центров кристаллизации, и зерна получаются мельче (рис. l.7.) Это подтверждается на практике в тонких сечениях литых деталей, охлаждающихся более быстро, металл всегда получается более мелкозернистым, чем в толстых массивных литых деталях, охлаждающихся медленнее.
Методом получения мелкого зерна при затвердевании металла является создание искусственных центров кристаллизации. Для этого в расплавленный металл вводят специальные вещества, называемые модификаторами; процесс искусственного регулирования размеров зерен получил название модифицирования.

Форма растущих кристаллов определяется не только условиями их столкновений между собой, но и составом сплава, наличием примесей и условиями охлаждения. В большинстве случаев при кристаллизации металлов механизм образования носит так называемый дендритный характер.
Дендритная кристаллизация характеризуется тем, что рост зародышей происходит с неравномерной скоростью. После образования зародышей их развитие идет главным образом в тех направлениях решетки; которые имеют наибольшую плотность упаковки атомов (минимальное межатомное расстояние).
В этих направлениях образуются длинные ветви будущего кристалла – так называемые оси первого порядка (1 на рис. 1.8.).
В дальнейшем от осей первого порядка под определенными углами начинают расти новые оси, которые называют осями второго порядка (2), от осей второго порядка растут оси третьего порядка (3) и т. д.
По мере кристаллизации образуются оси более высокого порядка (четвертого, пятого, шестого и т. д.), которые постепенно заполняют все промежутки, ранее занятые жидким металлом.
В условиях, при которых не хватает жидкого металла для заполнения пространства между осями, например, при затвердевании последних объемов слитком, дендритное строение выявляется весьма отчетливо рис. 1.8.
Последнее изменение этой страницы: 2016-12-16; Нарушение авторского права страницы
Подготовка к ЕГЭ по химии и олимпиадам
Темы кодификатора ЕГЭ: Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно озучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом .
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости .
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом .

Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 о С она замерзает – переходит из жидкого состояния в твердое, и при 100 о С закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность – это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.

В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным . Примеры аморфных веществ – уголь, слюдяное стекло.

Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом , а саму структуру – кристаллической решеткой . Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку , различают атомную, молекулярную, ионную и металлическую кристаллическую структуру .
Атомная кристаллическая решетка

Атомная кристаллическая решетка образуется, когда в узлах кристалла расположены атомы . Атомы соединены между собой прочными ковалентными химическими связями. Соответственно, такая кристаллическая решетка будет очень прочной, разрушить ее непросто. Атомную кристаллическую решетку могут образовывать атомы с высокой валентностью, т.е. с большим числом связей с соседними атомами (4 или больше). Как правило, это неметаллы: простые вещества — кремния, бора, углерода (аллотропные модификации алмаз, графит), и их соединения (бороуглерод, оксид кремния (IV) и др.). Поскольку между неметаллами возникает преимущественно ковалентная химическая связь, свободных электронов (как и других заряженных частиц) в веществах с атомной кристаллической решеткой в большинстве случаев нет. Следовательно, такие вещества, как правило, очень плохо проводят электрический ток, т.е. являются диэлектриками. Это общие закономерности, из которых есть ряд исключений.

Связь между частицами в атомных кристалалах: ковалентная полярная или неполярная.
В узлах кристалла с атомной кристаллической структурой расположены атомы.
Фазовое состояние атомных кристаллов при нормальных условиях: как правило, твердые вещества.
Вещества , образующие в твердом состоянии атомные кристаллы:
- Простые веществас высокой валентностью (расположены в середине таблицы Менделеева): бор, углерод, кремний, и др.
- Сложные вещества, образованные этими неметаллами: кремнезем (оксид кремния, кварцевый песок) SiO2; карбид кремния (корунд) SiC; карбид бора, нитрид бора и др.
Физические свойства веществ с атомной кристаллической решеткой:
— прочность;
— тугоплавкость (высокая температура плавления);
— низкая электропроводность;
— низкая теплопроводность;
— химическая инертность (неактивные вещества);
— нерастворимость в растворителях.
Молекулярная кристаллическая решетка

Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водродные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить. Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные. Чем больше сила притяжения между молекулами, тем выше температура плавления вещества. Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей. Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О2, азот N2, вода H2O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло.

Связь между частицами в молекулярных кристалалах: межмолекулярные водородные связи, электростатические или межмолекулярные силы притяжения.
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы.
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества.
Вещества , образующие в твердом состоянии молекулярные кристаллы:
- Простые вещества-неметаллы, образующие маленькие прочные молекулы(O2, N2, H2, S8 и др.);
- Сложные вещества (соединения неметаллов) с ковалентными полярными связями(кроме оксидов кремния и бора, соединений кремния и углерода) — вода H2O, оксид серы SO3 и др.
- Одноатомные инертные газы (гелий, неон, аргон, криптони др.);
- Большинство органических веществ, в которых нет ионных связей — метан CH4, бензол С6Н6 и др.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Ионная кристаллическая решетка

В случае, если в узлах кристалла находятся заряженные частицы – ионы, мы можем говорить о ионной кристаллической решетке . Как правило, с ионных кристаллах чередуются положительные ионы (катионы) и отрицательные ионы (анионы), поэтому частицы в кристалле удерживаются силами электростатического притяжения . В зависимости от типа кристалла и типа ионов, образующих кристалл, такие вещества могут быть довольно прочными и тугоплавкими. В твердом состоянии подвижных заряженных частиц в ионных кристаллах, как правило, нет. Зато при растворении или расплавлении кристалла ионы высвобождаются и могут двигаться под действием внешнего электрического поля. Т.е. проводят ток только растворы или расплавы ионных кристаллов. Ионная кристаллическая решетка характерна для веществ с ионной химической связью. Примеры таких веществ – поваренная соль NaCl, карбонат кальция – CaCO3 и др. Ионную кристаллическую решетку, как правило, в твердой фазе образуют соли, основания, а также оксиды металлов и бинарные соединения металлов и неметаллов.

Связь между частицами в ионных кристаллах: ионная химическая связь.
В узлах кристалла с ионной решеткой расположены ионы.
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества.
Химические вещества с ионной кристаллической решеткой:
- Соли (органические и неорганические), в том числе соли аммония (например, хлорид аммония NH4Cl);
- Основания;
- Оксиды металлов;
- Бинарные соединения, в составе которых есть металлы и неметаллы.
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.
Металлическая кристаллическая решетка

И, наконец, металлы характеризуются особым видом пространственной структуры – металлической кристаллической решеткой, которая обусловлена металлической химической связью . Атомы металлов довольно слабо удерживают валентные электроны. В кристалле, образованном металлом, происходят одновременно следующие процессы: часть атомов отдает электроны и становится положительно заряженными ионами; эти электроны хаотично перемещаются в кристалле; часть электронов притягивается к ионам. Эти процессы происходят одновременно и хаотично. Таким образом, возникают ионы , как при образовании ионной связи, и образуются общие электроны , как при образовании ковалентной связи. Свободные электроны перемещаются хаотично и непрерывно по всему объему кристалла, как газ. Поэтому иногда их называют « электронным газом ». Из-за наличия большого числа подвижных заряженных частиц металлы проводят ток, тепло. Температура плавления металлов сильно варьируется. Металлы также характеризуются своеобразным металлическим блеском, ковкостью, т.е. способностью изменять форму без разрушения при сильном механическом воздействии, т.к. химические связи при этом не разрушаются.

Связь между частицами : металлическая химическая связь.
В узлах кристалла с металлической решеткой расположены ионы металлов и атомы.
Фазовое состояние металлов при обычных условиях: как правило, твердые вещества (исключение — ртуть, жидкость при обычных условиях).
Химические вещества с металлической кристаллической решеткой — простые вещества-металлы.
Физические свойства веществ с металлической кристаллической решеткой:
— высокая тепло- и электропроводность;
— ковкость и пластичность;
— металлический блеск;
— металлы, как правило, нерастворимы в растворителях;
— большинство металлов – твердые вещества при нормальных условиях.
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные физические свойства вещества. Для примерного сравнения типичных физических свойств соединений с разными кристаллическими решетками очень удобно использовать химические вещества с характерными свойствами. Для молекулярной решетки это, например, углекислый газ, для атомной кристаллической решетки — алмаз, для металлической — медь, и для ионной кристаллической решетки — поваренная соль, хлорид натрия NaCl.

Сводная таблица по структурам простых веществ, образованных химическими элементами из главных подгрупп таблицы Менделеева (элементы побочных подгрупп являются металлами, следовательно, имеют металлическую кристаллическую решетку).

Итоговая таблица связи свойств веществ со строением:
Методы исследования строения металлов
Реальное строение металлических кристаллов
Кристаллизация металлов
Твердые вещества по взаимному расположению атомов делят на аморфные и кристаллические. Аморфными называют твердые вещества, атомы которых располагаются в пространстве хаотично. При нагревании они размягчаются и переходят в жидкое состояние в широком интервале температур и на кривой нагрева (на штриховой на рис.1) не выражен этот переход. К таким веществам относят стекло, смолу, канифоль, клей и др.
Кристаллическими называют твердые вещества, в которых атомы расположены в пространстве в строго определенном порядке. Эти вещества при нагреве остаются в твердом состоянии и переходят в жидкое при определенной температуре (рис.1, сплошная линия).
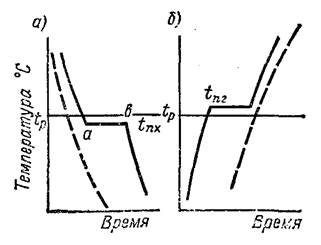
Все металлы являются кристаллическими веществами. Для описания кристаллической структуры металлов пользуются понятием
кристаллической решетки. Кристаллическая решетка — это воображаемая пространственная сетка, в узлах которой расположены атомы. Наименьшая часть кристаллической решетки, определяющая структуру металла, называется элементарной кристаллической ячейкой. Элементарная ячейка повторяется во всех трех измерениях и полностью характеризует структуру кристалла. На рис. 2 изображены элементарные ячейки для наиболее распространенных кристаллических решеток, которые имеют металлы:
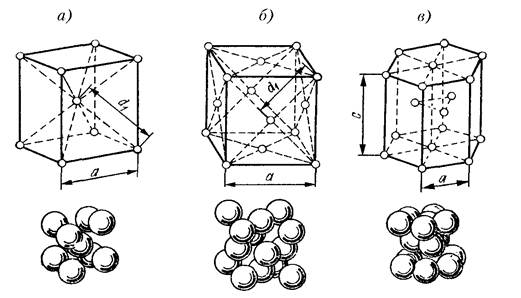
Рис.2.Пространственные кристаллические решетки:
а) кубическая объемно-центрированная; б) кубическая гранецентрированная: в) гексагональная плотноупакованная.
На рис.2,а приведена схема элементарной ячейки кубической объемно-центрированной решетки; она ограничивается девятью атомами, восемь из которых расположены по вершинам куба, а девятый – в его центре. Повторением этой ячейки путем переносов образуется вся структура кристалла.
Элементарная ячейка кубической гранецентрированной решетки (рис. 2, б) ограничивается 14 атомами: восемь из них расположены по вершинам куба, шесть — по его граням..
На рис. 2,в приведена схема элементарной ячейки гексагональной решетки. Она ограничена 17 атомами, из которых 12 расположены по вершинам шестигранной призмы, два атома — в центре оснований и три -внутри призмы.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Увлечёшься девушкой-вырастут хвосты, займёшься учебой-вырастут рога 9589 —  | 7565 —
| 7565 —  или читать все.
или читать все.
91.146.8.87 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно



Отправить ответ