Удельная теплота плавления вольфрама
Содержание:
- 1 Плотность вольфрама, его теплопроводность, теплоемкость и другие свойства
- 2 Содержание
- 3 История и происхождение названия [ править | править код ]
- 4 Нахождение в природе [ править | править код ]
- 5 Получение [ править | править код ]
- 6 Физические свойства [ править | править код ]
- 7 Химические свойства [ править | править код ]
- 8 Применение [ править | править код ]
- 9 Биологическая роль [ править | править код ]
- 10 Изотопы [ править | править код ]
- 11 СТРУКТУРА
- 12 СВОЙСТВА
- 13 ЗАПАСЫ И ДОБЫЧА
- 14 ПРОИСХОЖДЕНИЕ
- 15 ПРИМЕНЕНИЕ
 Представлена плотность вольфрама, его теплопроводность и теплоемкость, а также другие теплофизические свойства при различных температурах — в интервале от 100 до 4000 К.
Представлена плотность вольфрама, его теплопроводность и теплоемкость, а также другие теплофизические свойства при различных температурах — в интервале от 100 до 4000 К.
Вольфрам W — твердый и сложный в механической обработке металл с температурой плавления более 3400°C. По температуре плавления он занимает второе место после углерода (графита или алмаза).
Теплопроводность вольфрама достаточно высока и при комнатной температуре равна 163 Вт/(м·К), что превышает теплопроводность даже некоторых сплавов алюминия. Вольфрам достаточно тяжелый металл — плотность вольфрама составляет более 19 кг/м 3 при комнатной температуре.
Удельная теплоемкость вольфрама имеет относительно не высокую величину, как и у других металлов с высокой плотностью. Теплоемкость вольфрама зависит от температуры и изменяется по данным таблицы в диапазоне от 87 до 270 Дж/(кг·град) для твердого металла.
Вольфрам имеет очень низкий коэффициент теплового расширения (КТлР), равный 4,43 ·10 -6 1/град при комнатной температуре. Вольфрам не окисляется при обычной температуре, но при высоких температурах реагирует с кислородом, образуя триоксид вольфрама красного цвета.
Теплофизические свойства вольфрама, представленные в таблице, следующие: плотность d, теплоемкость Cp, температуропроводность a, коэффициент теплопроводности λ, удельное электрическое сопротивление ρ, функция Лоренца L/L. Свойства вольфрама даны в зависимости от температуры — в интервале от 100 до 3695 К для твердого состояния этого металла, а также при температуре до 4000 К для расплавленного жидкого вольфрама.
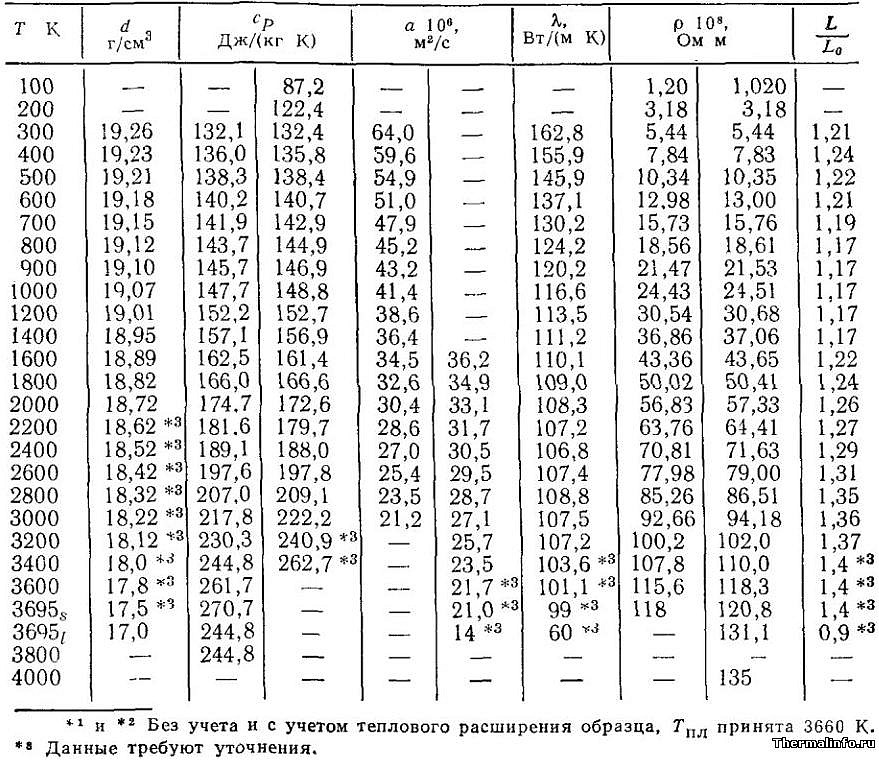
Плотность вольфрама, его теплопроводность, теплоемкость и другие свойства
В таблице представлены теплопроводность и теплофизические свойства вольфрама W чистотой 99,9% в интервале температуры от 100 до 2700 К. Даны следующие свойства чистого вольфрама: плотность, удельная массовая теплоемкость, теплопроводность, коэффициент теплового расширения (КТР), удельное электрическое сопротивление. Плотность вольфрама при нагревании уменьшается из-за теплового расширения.
По данным таблицы видно, что при нагревании чистого вольфрама его теплопроводность уменьшается, теплоемкость увеличивается, а плотность почти не изменяет свое значение. Например, удельная теплоемкость вольфрама равна 134,4 Дж/(кг·град) при комнатной температуре, а при нагревании этого металла до 2100°C, теплоемкость возрастает до величины 175 Дж/(кг·град).
| Вольфрам | |
|---|---|
| ← Тантал | Рений → | |
| 74 | Mo ↑ W ↓ Sg |

(молярная масса)
W ← W 6+ 0,68 В
(первый электрон)
52,31 [3] [4] кДж/моль
объёмноцентрированная
Вольфрам — самый тугоплавкий из металлов. Более высокую температуру плавления имеет только неметаллический элемент — углерод, но он существует в жидком виде только при высоких давлениях. При стандартных условиях вольфрам химически стоек.
Содержание
История и происхождение названия [ править | править код ]
Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья пена» — лат. spuma lupi или нем. Wolf Rahm [5] [7] . Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирал олово как волк овцу»).
В английском и французском языках вольфрам называется tungsten (от швед. tung sten — «тяжёлый камень»). В 1781 году знаменитый шведский химик Карл Шееле, обрабатывая азотной кислотой минерал шеелит, получил жёлтый «тяжёлый камень» (триоксид вольфрама) [ источник не указан 2416 дней ] . В 1783 году испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита как растворимой в аммиаке жёлтой окиси нового металла, так и самого металла [ источник не указан 2416 дней ] . При этом один из братьев, Фаусто, был в Швеции в 1781 году и общался с Шееле. Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
Нахождение в природе [ править | править код ]
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,00013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трёхокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца n FeWO4 · m MnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Месторождения [ править | править код ]
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее. Мировое производство вольфрама составляет 49—50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.
Также есть месторождения вольфрама в Армении и других странах.
Получение [ править | править код ]

Процесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Физические свойства [ править | править код ]
Вольфрам — блестящий светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). Температура плавления — 3695 K (3422 °C), кипит при 5828 K (5555 °C) [2] . Плотность чистого вольфрама составляет 19,25 г/см³ [2] . Обладает парамагнитными свойствами (магнитная восприимчивость 0,32⋅10 −9 ). Твёрдость по Бринеллю 488 кг/мм², удельное электрическое сопротивление при 20 °C — 55⋅10 −9 Ом·м, при 2700 °C — 904⋅10 −9 Ом·м. Скорость звука в отожжённом вольфраме 4290 м/с.
Вольфрам является одним из наиболее тяжёлых, твёрдых и самых тугоплавких металлов [5] . В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддаётся ковке и может быть вытянут в тонкую нить. Металл обладает высокой устойчивостью в вакууме [8] .
Химические свойства [ править | править код ]
Проявляет валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама (VI). Вольфрам в ряду напряжений стоит сразу после водорода, и в соляной, разбавленной серной и плавиковой кислотах почти нерастворим. В азотной кислоте и царской водке окисляется с поверхности. Растворяется в перекиси водорода.
Легко растворяется в смеси азотной и плавиковой кислот [9] :
2 W + 4 H N O 3 + 10 H F ⟶ W F 6 + W O F 4 + 4 N O ↑ + 7 H 2 O <displaystyle <mathsf <2W+4HNO_<3>+10HFlongrightarrow WF_<6>+WOF_<4>+4NOuparrow +7H_<2>O>>>
Реагирует с расплавленными щелочами в присутствии окислителей [10] :
2 W + 4 N a O H + 3 O 2 ⟶ 2 N a 2 W O 4 + 2 H 2 O <displaystyle <mathsf <2W+4NaOH+3O_<2>longrightarrow 2Na_<2>WO_<4>+2H_<2>O>>> 
Поначалу данные реакции идут медленно, однако при достижении 400 °C (500 °C для реакции с участием кислорода) вольфрам начинает саморазогреваться, и реакция протекает достаточно бурно, с образованием большого количества тепла.
Растворяется в смеси азотной и плавиковой кислоты, образуя гексафторвольфрамовую кислоту H2[WF6]. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Применение [ править | править код ]
Главное применение вольфрама — как основа тугоплавких материалов в металлургии.
Металлический вольфрам [ править | править код ]

- Тугоплавкость и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
- Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
- Вольфрам используют в качестве электродов для аргонно-дуговой сварки.
- Сплавы вольфрама, ввиду его высокой температуры плавления, получают методом порошковой металлургии. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей.
- Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
- Высокая плотность вольфрама делает его удобным для защиты от ионизирующего излучения. Несмотря на бо́льшую плотность по сравнению с традиционным и более дешёвым свинцом, защита из вольфрама оказывается менее тяжёлой при равных защитных свойствах [11] или более эффективной при равном весе [12] . Из-за тугоплавкости и твёрдости вольфрама, затрудняющих его обработку, в таких случаях используются более пластичные сплавы вольфрама с добавлением никеля, железа, меди и др. [13] либо взвесь порошкообразного вольфрама (или его соединений) в полимерной основе [14] .
Соединения вольфрама [ править | править код ]
- Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам.
- Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка.
- Некоторые соединения вольфрама применяются как катализаторы и пигменты.
- Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
- Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К).
Другие сферы применения [ править | править код ]
Искусственный радионуклид 185 W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184 W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Рынок вольфрама [15] [ править | править код ]
Цены на металлический вольфрам (содержание элемента порядка 99 %) на конец 2010 года составляли около 40—42 долларов США за килограмм, в мае 2011 года составляли около 53—55 долларов США за килограмм. Полуфабрикаты от 58 USD (прутки) до 168 (тонкая полоса). В 2014 году цены на вольфрам колебались в диапазоне от 55 до 57 USD.
Биологическая роль [ править | править код ]
Вольфрам не играет значительной биологической роли. У некоторых архебактерий и бактерий имеются ферменты, включающие вольфрам в своем активном центре. Существуют облигатно-зависимые от вольфрама формы архебактерий-гипертермофилов, обитающие вокруг глубоководных гидротермальных источников. Присутствие вольфрама в составе ферментов может рассматриваться как физиологический реликт раннего архея — существуют предположения, что вольфрам играл роль в ранних этапах возникновения жизни [16] .
Пыль вольфрама, как и большинство других видов металлической пыли, раздражает органы дыхания.
Изотопы [ править | править код ]
Известны изотопы вольфрама с массовыми числами от 158 до 192 (количество протонов 74, нейтронов от 84 до 118), и более 10 ядерных изомеров. [17]
Природный вольфрам состоит из смеси пяти изотопов ( 180 W — 0,12(1)%, 182 W — 26,50(16) %, 183 W — 14,31(4) %, 184 W — 30,64(2) % и 186 W — 28,43(19) %) [17] . В 2003 открыта [18] чрезвычайно слабая радиоактивность природного вольфрама (примерно два распада на грамм элемента в год), обусловленная α-активностью 180 W, имеющего период полураспада 1,8⋅10 18 лет [19] .
 Вольфрам — самый тугоплавкий из металлов. Более высокую температуру плавления имеет только неметаллический элемент — углерод. При стандартных условиях химически стоек. Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием лат. Spuma lupi («волчья пена») или нем. Wolf Rahm («волчьи сливки», «волчий крем»). Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирает олово как волк овцу»).
Вольфрам — самый тугоплавкий из металлов. Более высокую температуру плавления имеет только неметаллический элемент — углерод. При стандартных условиях химически стоек. Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием лат. Spuma lupi («волчья пена») или нем. Wolf Rahm («волчьи сливки», «волчий крем»). Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирает олово как волк овцу»).
СТРУКТУРА
В объемно-центрированной кубической ячейке вольфрама атомы располагаются по вершинам и в центре ячейки, т.е. на одну ячейку приходится два атома. ОЦК-структура не является плотнейшей упаковкой атомов. Коэффициент компактности равен 0,68. Пространственная группа вольфрама Im3m.
СВОЙСТВА
 Вольфрам — блестящий светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). Температура плавления — 3695 K (3422 °C), кипит при 5828 K (5555 °C). Плотность чистого вольфрама составляет 19,25 г/см³. Обладает парамагнитными свойствами (магнитная восприимчивость 0,32·10−9). Твердость по Бринеллю 488 кг/мм², удельное электрическое сопротивление при 20 °C — 55·10−9 Ом·м, при 2700 °C — 904·10−9 Ом·м. Скорость звука в отожжённом вольфраме 4290 м/с. Является парамагнетиком.
Вольфрам — блестящий светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). Температура плавления — 3695 K (3422 °C), кипит при 5828 K (5555 °C). Плотность чистого вольфрама составляет 19,25 г/см³. Обладает парамагнитными свойствами (магнитная восприимчивость 0,32·10−9). Твердость по Бринеллю 488 кг/мм², удельное электрическое сопротивление при 20 °C — 55·10−9 Ом·м, при 2700 °C — 904·10−9 Ом·м. Скорость звука в отожжённом вольфраме 4290 м/с. Является парамагнетиком.
Вольфрам является одним из наиболее тяжелых, твердых и самых тугоплавких металлов. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддается ковке и может быть вытянут в тонкую нить.
ЗАПАСЫ И ДОБЫЧА
 Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,00013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,00013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Процесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре около 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
ПРОИСХОЖДЕНИЕ
 Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 * mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 * mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее. Мировое производство вольфрама составляет 49—50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.
Также есть месторождения вольфрама в Армении и других странах.
ПРИМЕНЕНИЕ
 Тугоплавкость и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
Тугоплавкость и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
Вольфрам используют в качестве электродов для аргоно-дуговой сварки. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей. Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам. ( Р18, Р6М5. от rapid — быстрый, скорость).
Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка. Некоторые соединения вольфрама применяются как катализаторы и пигменты. Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К). Искусственный радионуклид 185 W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184 W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).






Отправить ответ