Какая твердость у железа
Содержание:
Железо (Ferrum) Fe, химический элемент VIII группы периодической системы, атомный номер 26, атомная масса 55,847. Состоит из четырех стабильных изотопов: 54 Fe (5,84%), 56 Fe (91,68%), 57 Fе (2,17%), 58 Fe (0,31%). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 2,62.10 — 28 м 2 .
Конфигурация внешних электронных оболочек 3d 6 4s 2 ; степени окисления +2 и +3 (наиболее характерны), +1, +4, +6, +8; энергия ионизации при последовательном переходе от Fe 0 к Fe 5+ 7,893, 16,183, 30,65, 57,79 эВ; сродство к электрону 0,58 эВ; электроотрицательность по Полингу 1,8; атомный радиус 0,126 нм, ионные радиусы (в нм, в скобках указаны ко-ординац. числа) для Fe 2+ 0,077 (4), 0,092 (6), 0,106 (8), для Fe 3+ 0,063 (4), 0,079 (6), 0,092 (8).
Железо — один из самых распространенных элементов в природе, его содержание в земной коре составляет 4,65% по массе. Известно свыше 300 минералов. из которых слагаются месторождения железных руд. Промышленное значение имеют руды с содержанием Fe св. 16%. Важнейшие рудные минералы Железо: магнетит (магнитный железняк) Fe 3 O 4 (содержит 72,4% Fe), гематит (железный блеск, красный железняк) Fe 2 O 3 (70% Fe), гётит a-FeO(OH), или Fe 2 O 3 .H 2 O, лепидокрокит g-FeO(OH) и гидрогётит (лимонит) Fe 2 O 3 . x H 2 O (ок. 62% Fe), сидерит FeCO 3 (48,2% Fe), ильменит FeTiO 3 (36,8% Fe). Наряду с полезными примесями — Mn, Cr, Ni, Ti, V, Co — железные руды содержат и вредные примеси — S, P и др. Железо входит в состав природных силикатов. значительные скопления которых могут иметь промышленное значение для производства железа или его соединений. Различают следующие основные типы железных руд.
Бурые железняки — руды гидроксидов Fe(III) (главный минерал — гётит); содержат до 66,1% Fe (чаще 30-55%); имеют осадочное происхождение. Крупнейшие месторождения в СССР, во Франции, в Гвинее. Гематитовые руды, или красные железняки (главный минерал — гематит); содержат обычно 50-65% Fe. Для них характерно залегание богатых руд поверх мощных толщ бедных (30-40% Fe) магнетитовых кварцитов. Крупнейшие месторождения в СССР, США, Канаде, Бразилии, Венесуэле. Магнетитовые руды, или магнитные железняки (главный минерал — магнетит); содержат чаще всего до 45-60% Fe. Верхние горизонты магнетитовых рудных тел обычно частично окислены до гематита (полумартиты и мартиты). Крупнейшие месторождения в СССР и Швеции. Силикатные руды (25-40% Fe) осадочного происхождения, используемые для выплавки чугуна в ГДР, Югославии, ЧССР и ряде других стран Европы, относятся к группе зеленых слюд-хлоритов. Главные минералы — шамозит Fe 4 (Fe, Al) 2 [Al 2 Si 2 O 10 ](OH) 8 и тюрингит (Mg, Fe) 3,5 Al 1,5 [Si 2,5 Al 1,5 O 10 ](ОН) 6 .nН 2 О — содержат до 42% Fe. Важнейшие месторождения в ГДР, Австрии и др.
Мировые разведанные запасы железных руд составляют 231,9 млрд. т, или 93 млрд. т в пересчете на Железо (1980). По запасам железных руд (балансовым — св. 100 млрд. т) СССР занимает первое место в мире. Наиб. запасы железных руд (в млрд. т), кроме СССР, сосредоточены в Бразилии (34), Канаде (26), Австрии (21), США (17), Индии (13), ЮАР (9), Швеции (4,5) и во Франции (4). Перспективно использование бедных Железо горных пород и железомарганцевых конкреций. Мировые запасы последних оцениваются в 3000 млрд. т (1984). В чрезвычайно редких случаях Железо встречается в земной коре в составе минерала иоцита FeO (аналог которого в технике называют вюститом), а также в виде самородного Железо — метеорного и теллурического (земного происхождения). Теллурическое железо образуется в результате восстановления оксидов и сульфидов Железо углеродом из железистой магмы и при подземных пожарах угля, контактирующего с пластами руды.
Железо входит в состав гемоглобина.
Свойства. Железо — блестящий серебристо-белый пластичный металл. При обычном давлении существует в четырех кристаллических модификациях. До 917 °С существует a-Fe с объемноцентрированной кубической решеткой ( а = 0,286645 нм, z = 2, пространств. группа Im3m); a-Fe ферромагнитно, но при 769 °С (точка Кюри) переходит в парамагнитное состояние без изменения сингонии и др. свойств, кроме магнитных; DH 0 перехода 1,72 кДж/моль. Парамагнитное железо (b-Fe) устойчиво в интервале 769-917 °С. В интервале 917-1394 °С существует g-Fe с гранецентрированной кубической решеткой (при 950 °С а = 0,3656 нм, z = 4, пространств. группа Fm3m); DH 0 перехода b : g 0,91 кДж/моль. Выше 1394°С существует d-Fe с объемноцентрированной кубической решеткой (при 1425°С а = 0,293 нм, z = 2, пространств. группа Im3m); DH 0 перехода g : d 0,63 кДж/моль. При высоких давлениях существует e-Fe с гексагональной плотноупакованной решеткой, которое также образуется и при нормальном давлении при легировании Железо рядом элементов. Ниже приводятся данные о физ. свойствах Железо с общим содержанием примесей не более 0,01%.
Т. пл. 1535 °С (DH 0 пл 16,6 кДж/моль), т. кип. 2750 °С (DH 0 исп 354,3 кДж/моль). Плотность (в г/см 3 ): a-Fe 7,87 (20 °С), 7,67 (600 °С); g-Fe 7,59 (1000 °С); d-Fe 7,409; жидкого железа 7,024 (1538°С), 6,962 (1600°С), 6,76 (1800°С); уравнение температурной зависимости плотности жидкого карбонильного железа (см. ниже): d = 8,618 — 8,83.10 — 4 T г/см 3 . Теплоемкость медленно увеличивается с ростом температуры до 523 К, затем резко возрастает, достигая максимума в точке Кюри. после чего снижается; С 0 р 25,14 Дж/(моль.К); S 0 298 27,30 Дж/(моль.К); уравнение температурной зависимости давления пара. lgp (в мм рт. ст.) = — 19710/T — l,271gT + 13,27 (1808-3023 К); температурный коэффициента линейного расширения 12.10 — 6 К — 1 (298 К), уравнение его температурной зависимости: a = 11,3.10 — 6 + 17,6.10 — 8 t — 1,68.10 — 11 t 2 o С — 1 (0-800°С). Теплопроводность [Вт/(м.К)], 132 (100 К), 80,3 (300 К), 69,4 (400 К), 32,6 (1000 К), 31,8 (1500 К); для армко-железа (см. ниже) 74,7 (273 К), 72,8 (298 К), 67,6 (373 К). Для 99,99%-ного Железо g в атмосфере Не 1,72 Н/м (1535°С); динамическая вязкость в интервале 1535-1700°С изменяется от 6,8.10 — 4 до 5,6.10 — 4 Па.с. Для 99,99%-ного Железо r 0,0327 мкОм.см (4,2 К), 9,71 мкОм.см (293 К), температурный коэффициент r 6,51.10 — 3 К — 1 (273-373 К); температура перехода в сверхпроводящее состояние 0,1125 К. Магнитная проницаемость 1,45.10 6 (для монокристалла), магнитная индукция насыщения 2,18 Тл; коэрцитивная сила 5-6 А/м (для карбонильного железа).
Для особо чистого железа ( — 7 % С + N, 10 — 5 % О, — 5 % S) s раст 50 МПа, предел текучести 20 МПа при скорости деформации 5.10 — 4 с — 1 и размере зерна 1 мм; ударная вязкость более 300 Дж/см 2 ; температура перехода в хрупкое состояние -85°С; для совершенных кристаллов ("усов") s раст 13,4 ГПа. Твердость по Моосу 4-5. Для отожженного образца относит. удлинение 40-50%, модуль сдвига 76,4-78,4 ГПа, твердость по Бринеллю 588-686 МПа. Железо — металл умеренной химической активности. Стандартный электродный потенциал Fe 2+ /Fe 0 -0,447 В, Fe 3+ /Fe 0 -0,037 В, Fе 3+ /Fе 2+ +0,771 В. Жидкое железо неограниченно растворяет Al, Cu, Mn, Ni, Co, Si, Ti, хорошо растворяет V, Сr и Pt, ограниченно — Mo, Sn, С, S, P, As, H 2 , N 2 , О 2 , не растворяет Pb, Ag, Bi. С углеродом образует твердые растворы внедрения — феррит и мартенсит с a-Fe, аустенит с g-Fe. В железа сплавах углерод присутствует также в виде графита и цементита Fe 3 C (см. табл.). В зависимости от содержания С в Железо различают: мягкое Железо ( x О ( х = 0,89-0,95), поверх него лежит слой Fe 3 O 4 , затем Fe 2 O 3 . Ржавление Железо (атм. коррозия) во влажном воздухе, особенно содержащем капли морской воды. идет быстрее; ржавчина содержит также и гидроксиды Железо, в основном FeO(OH). О кислородных соединениях железа смотри железа оксиды. Железо не растворяется в воде и растворах холодных щелочей. реагирует с разбавленными кислотами, образуя соли Fe(II), и горячими концентрированными растворами щелочей. Конц. HNO 3 и H 2 SO 4 пассивируют железо благодаря образованию нерастворимой в кислотах оксидной пленки.
Азот в малых концентрациях образует с Железо твердые растворы внедрения, в больших — нитриды Fe 2 N и др. При нормальном давлении ок. 917°С растворимость N 2 в a-Fe до 0,01 ат. %, в g-Fe ок. 0,1 ат. %. Железо способно поглощать Н 2 при травлении кислотами и в процессе катодного выделения железа при электролизе. Адсорбируясь на дефектах структуры, водород резко снижает прочность и пластичность железа (так называемая водородная хрупкость). Твердое железо поглощает Н 2 с образованием твердых растворов внедрения. Растворимость Н 2 в Железо при комнатной температуре менее 0,005%, в расплавленном железе — почти в 25 раз больше. Гидриды железа существуют только при высоких давлениях Н 2 ; известны гидриды интерметаллидов железа, например TiFeH 2 (см. Гидриды ). С СО железо образует железа карбонилы, в которых железо формально проявляет нулевую степень окисления.
При нагревании железо реагирует с галогенами, особенно легко с Сl 2 , т. к. образующийся FeCl 3 летуч (см. Железа хлориды ) и не создает на поверхности металла защитной пленки. Напротив, FeF 3 нелетуч, поэтому компактное железо устойчиво к действию F 2 до 250-300 °С.

Реакция железа с S экзотермична, начинается при слабом нагревании, при этом образуется нестехиометрический сульфид, близкий по составу к FeS. В природе распространен минерал пирит FeS 2 (см. Железа сульфиды ) . Фосфор при малых концентрациях дает с железом ограниченные твердые растворы, при больших концентрациях — фосфиды, из которых наиболее устойчивы Fe 3 P, Fe 2 P, FeP и FeP 2 .
Железо образует два ряда солей — соединения Fe(II) и Fe(III). Соли Fe(II) гидролизуются, в числе продуктов гидролиза образуются различные полиядерные комплексы; на воздухе окисляются до Fe(III). Более устойчивы двойные соли, например, соль Мора FeSO 4 .(NH 4 ) 2 SO 4 .6H 2 O (см. Железа сульфаты ), и комплексные. В водном растворе Fe 2+ образует аквакомплексы, например, состава [Fe(H 2 O) 6 ] 2+ , часто сохраняющиеся и в высших кристаллогидратах солей. Растворы солей Fe 2+ практически бесцветны, т. к. окраска [Fe(H 2 O) 6 ] 2+ очень слабая (зеленоватая). При действии Na 2 CO 3 на растворы Fe 2+ осаждается карбонат FeCO 3 , который при действии избытка СО 2 переходит в раствор в виде Fe(HCO 3 ) 2 . Наиболее прочные комплексы Fe(II) — цианистые, например K 4 [Fe(CN) 6 ] (см. Калия гексацианоферраты ). Соли Fe(II) — восстановители в водных растворах.
Соли Fe(III) образуются при окислении солей Fe(II) и др. способами; гидролизуются (с образованием различных полиядерных комплексов) сильнее, чем соли Fe(II). Гидратированный ион Fe 3+ почти бесцветен, но растворы солей Fe 3+ обычно имеют бурую окраску из-за образования гидроксосоединений. Растворы Fe 3+ с MNCS дают кроваво-красный раствор тиоцианата Fe(NCS) 3 , с K 4 [Fe(CN) 6 ] — ярко-синий осадок берлинской лазури (турнбулевой сини) приблизительного состава KFe III [Fe II (CN) 6 ]. При взаимодействии растворов солей Fe(III) с (NH 4 ) 2 C 2 O 4 образуется оксалат Fe 2 (C 2 O 4 ) 3 (т. разл. 100°С), применяемый для получения светокопировальной бумаги. Сульфат Fe(III) образует двойные сульфаты (см. Квасцы ) . Амминокомплексы Fe(II) и Fe(III) образуются при действии NH 3 на безводные соли; водой разлагаются.
Степень окисления +6 железо проявляет в ферратах(VI), например BaFeO 4 , K 2 FeO 4 , +4 — в тетранитрозиле Fe(NO) 4 , который образуется при действии NO на Железо при повыш. давлении, и ферратах(IV) составов M II FeO 3 , M I 2 FeO 3 , M I 4 FeO 4 , легко образующихся в водных щелочных средах при окислении О 2 . При анодном растворении железа при высоких плотностях тока образуется феррат(VIII) неопределенного состава.
Получение. Схема металлургического передела железных руд включает дробление, измельчение, обогащение магнитной сепарацией (до содержания Fe 64-68%), получение концентрата (74-83% Fe), плавку; основную массу железа выплавляют в виде чугуна и стали (см. Железа сплавы ). Технически чистое железо, или армко-железо (0,02% С, 0,035% Мn, 0,14% Сr, 0,02% S, 0,015% Р), выплавляют из чугуна в сталеплавильных печах или кислородных конвертерах. Чистое железо получают: восстановлением оксидов железа твердым (кокс, каменноугольная пыль), газообразным (Н 2 , СО, их смесь, природный конвертированный газ) или комбинированным восстановителем; электролизом водных растворов или расплавов солей Железо; разложением пентакарбонила Fe(CO) 5 (карбонильное Железо). Сварочное, или кричное, Железо производят окислением примесей малоуглеродистой стали железистым шлаком при 1350°С или восстановлением из руд твердым углеродом. Восстановлением оксидов железа при 750-1200°С получают губчатое железо (97-99% Fe) — пористый агломерат частиц железа; пирофорно; в горячем состоянии поддается обработке давлением. Карбонильное железо (до 0,00016% С) получают разложением Fe(CO) 5 при 300 °С в среде NH 3 с послед. восстановит. отжигом в среде Н 2 при 500-600 °С; порошок с размером частиц 1-15 мкм; перерабатывается методами порошковой металлургии. Особо чистое железо получают зонной плавкой и др. методами.
Определение. Качественно Fe(II) обнаруживают по образованию берлинской лазури с K 3 [Fe(CN) 6 ], Fe(III) — пo образованию ее же с K 2 [Fe(CN) 6 ] или Fe(CNS) 3 с тиоцианатом аммония или К. Количественно Fe(II) определяют с помощью дихроматометрии или перманганатометрии, Fе(III) — иодометрическим или комплексонометрическим титрованием с трилоном Б и индикатором (сульфосалициловая кислота), Fe(II) и Fe(III) — колориметрически с сульфосалициловой кислотой. Для определения железа используют также спектральный, рентгенофлуоресцентный и термометрический методы, мёссбауэровскую спектроскопию и др. Примеси в Железо определяют методами газового анализа, масс-спектрометрическим, активационным, кондуктометрическим, спектральным и другие.
Применение. Технически чистое железо — материал для сердечников электромагнитов и якорей электромашин, пластин аккумуляторов. Карбонильное железо используют для нанесения тончайших пленок и слоев на магнитофонные ленты, как катализатор, антианемическое средство и др. Из губчатого железа выплавляют высококачественные стали. Железный порошок используют для сварки, а также для цементации меди. Искусственные радиоактивные изотопы 55 Fe (T 1/2 2,6 ч) и 59 Fe (T l/2 45,6 сут) — изотопные индикаторы.
Лит.. Федоров А. А., Новые методы анализа металлических порошков и шлаков, М., 1971, с. 62-109. 226-36; Каменецкая Д. С., Пилецкая И. Б., Ширяев В. И. Железо высокой степени чистоты. М., 1978; Каспарова О. В. [и др.], "Защита металлов". 1985, т. 21. № 3. с. 339-45; Перфильев Ю. Д. [и др.]. "Докл. АН СССР". 1987. т. 296, № 6, с. 1406-09. См. также лит. при ст. Железа сплавы. Е. Ф. Вегман.

Чистое железо (99,97%), очищенное методом электролиза
Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Смотрите так же:
СТРУКТУРА
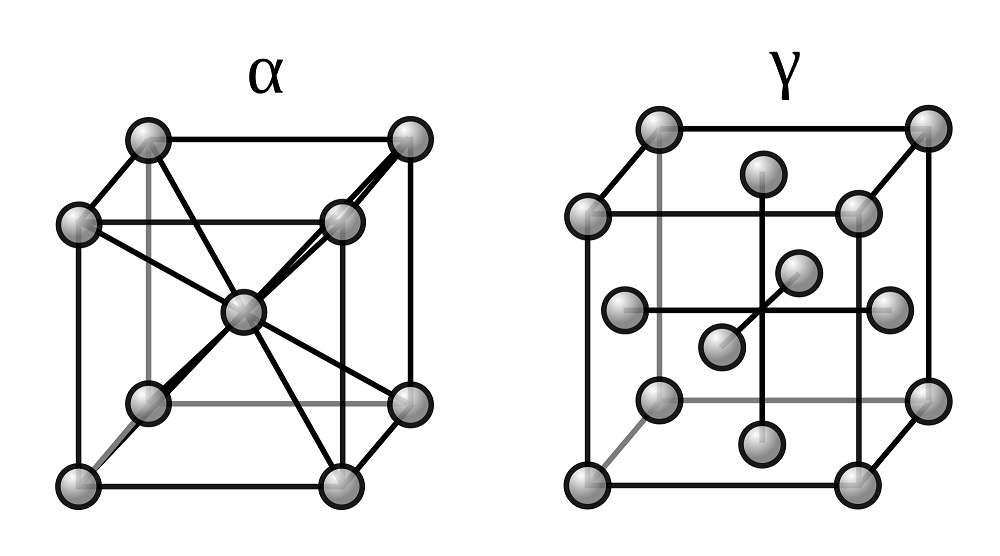
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10 −5 -1·10 −8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ

Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Материал из ТеплоВики — энциклопедия отоплении
Железо (Fe (ferrum)) — химический элемент VIIIB подгруппы периодической системы элементов, металл, член триады железа (Fe, Co, Ni). Железо самородное редко встречается в природе, главным образом в минералах феррит, аваруит и метеоритах (т.н. метеоритное железо, которое содержит более 90% Fe). В соединениях с кислородом и другими элементами широко распространено в составе многих минералов и руд. По распространенности в земной коре (5,00%) это третий (после кремния и алюминия) элемент; считается, что земное ядро состоит в основном из железа. Основные минералы — гематит (красный железняк) Fe2O3; лимонит Fe2O3·nH2O (n = 1 — 4), содержащийся, например, в болотной руде; магнетит (магнитный железняк) Fe3O4 и сидерит FeCO3. Наиболее распространенным минералом железа, не являющимся, однако, источником его получения, является пирит (серный колчедан, железный колчедан) FeS2, который иногда называют за его желтый блеск золотом дураков или кошачьим золотом, хотя он в действительности часто содержит небольшие примеси меди, золота, кобальта и других металлов.
| СВОЙСТВА ЖЕЛЕЗА | |
|---|---|
| Атомный номер | 26 |
| Атомная масса | 55,847 |
| Изотопы: | |
| стабильные | 54, 56, 57, 58 |
| нестабильные | 52, 53, 55, 59 |
| Температура плавления, °С | 1535 |
| Температура кипения, °С | 3000 |
| Плотность, г/см3 | 7,87 |
| Твердость (по Моосу) | 4,0-5,0 |
| Содержание в земной коре, % (масс.) | 5,00 |
| Степень окисления: | |
| характерная | +2, +3 |
| прочие значения | +1, +4, +6 |
Содержание
История
Железо (элементное) известно и используется с доисторических времен. Первые изделия из железа, вероятно, были изготовлены из метеоритного железа в виде амулетов, драгоценностей и рабочего инструмента. Около 3500 лет назад человек открыл способ восстановления красной земли, содержащей оксид железа, в металл. С тех пор из железа было изготовлено огромное количество различных изделий. Оно сыграло важную роль в развитии материальной культуры человечества. В наши дни железо в основном (95%) выплавляют из руд в виде чугунов и сталей и в сравнительно небольших количествах получают восстановлением металлизованных окатышей, а чистое железо — термическим разложением его соединений или электролизом солей.
Свойства
Металлическое железо представляет собой серовато-белое блестящее твердое пластичное вещество. Железо кристаллизуется в трех модификациях (α, γ, δ). α-Fe имеет объемноцентрированную кубическую кристаллическую решетку, химически устойчиво до 910°С. При 910°С α-Fe переходит в γ-Fe, стабильное в интервале 910—1400°С; γ-Fe кристаллизуется в гранецентрированной кубической кристаллической решетке. При температуре выше 1400°С образуется δ-Fe с решеткой, в основном аналогичной решетке α-Fe. Железо — ферромагнетик, оно легко намагничивается, но теряет магнитные свойства при снятии магнитного поля. С повышением температуры магнитные свойства железа ухудшаются и выше 769°С оно практически не поддается намагничиванию (иногда железо в интервале 769—910°С называют &betta;-Fe); γ-Fe не является магнитным материалом.
Использование
Железо — один из самых пригодных к эксплуатации металлов в сплаве с углеродом (сталь, чугун) — высокопрочная основа конструкционных материалов. Как материал, обладающий магнитными свойствами, железо используется для сердечников электромагнитов и якорей электромашин, а также в качестве слоев и пленок на магнитных лентах. Чистое железо — катализатор в химических процессах, компонент лекарственных средств в медицине.
Железо как химический компонент организма
Железо является существенным химическим компонентом организмов многих позвоночных, беспозвоночных и некоторых растений. Оно входит в состав гема (пигмента эритроцитов — красных кровяных клеток) гемоглобина крови, мышечных тканей, костного мозга, печени и селезенки. Каждая молекула гемоглобина содержит 4 атома железа, которые способны создавать обратимую и непрочную связь с кислородом, образуя оксигемоглобин. Кровь, содержащая оксигемоглобин, циркулирует по телу, поставляя кислород к тканям для клеточного дыхания. Поэтому железо необходимо для дыхания и образования красных кровяных клеток. Миоглобин (или мышечный гемоглобин) снабжает кислородом мышцы. Общее количество железа в человеческом теле (средней массы 70 кг) составляет 3—5 г. Из этого количества 65% Fe находится в гемоглобине. От 10 до 20 мг Fe ежедневно требуется для обеспечения нормального метаболизма среднего взрослого. Красное мясо, яйца, желток, морковь, фрукты, любая пшеница и зеленые овощи в основном обеспечивают организм железом при нормальном питании; при анемии, связанной с недостатком железа в организме, принимают лекарственные препараты железа.
Железо как хим. элемент
С химической точки зрения железо — довольно активный металл, проявляет характерные степени окисления +2, +3, реже +1, +4, +6. Непосредственно соединяется с некоторыми элементами, с S образует FeS — сульфид железа(III), с галогенами, кроме иода, — галогениды железа(III), такие, как FeCl3. Легко окисляется; с кислородом дает оксиды FeO, Fe2O3, Fe3O4 (FeO + Fe2O3), легко корродирует (ржавеет). Вытесняет водород из паров воды при высокой температуре. Растворяется в разбавленных кислотах (например, HCl, H2SO4, HNO3), вытесняя водород и образуя соли Fe(II) (соответственно FeCl2, FeSO4, Fe(NO3)2). В умеренно концентрированных H2SO4 и HNO3 железо растворяется с образованием солей Fe(III), а в сильноконцентрированных — пассивируется и не реагирует. Пассивность железа, по-видимому, объясняется образованием на его поверхности пленки оксида железа, которая, однако, легко разрушается при простом соскабливании.
Коррозия железа
Ржавление железа (атмосферная коррозия железа) — это окисление его кислородом воздуха. Реакция происходит в присутствии ионов солей, растворенных в воде, и ионов, образующихся при диссоциации угольной кислоты — продукта взаимодействия атмосферного углекислого газа и влаги. В результате образуется рыхлая ржавчина красного цвета, или гидратированный оксид состава Fe2O3·nH2O.
Соединения
Соли железа(II) обычно зеленого цвета, легко окисляются на воздухе. Кристаллогидрат хлорида железа FeCl2·4H2O быстро впитывает влагу из окружающей среды. Его используют как протраву в текстильной промышленности и как вяжущее в медицине. Кристаллогидрат сульфата железа(II) FeSO4·7H2O (железный купорос) применяют в производстве чернил, красок, пигментов и как дезинфицирующее средство. При кристаллизации сульфата железа из раствора, содержащего также сульфат аммония, образуется двойной сульфат железа и аммония, или соль Мора FeSO4·(NH4)2·6H2O, устойчивая к окислению на воздухе; ее используют для получения растворов, содержащих ионы Fe(II), пригодные для длительного хранения.
Соли Fe(III), обычно красного или желтого цвета, легко восстанавливаются и гидролизуются, образуя кислые растворы. Растворы FeCl3 в спирте или в воде используют для остановки кровотечения или как тонизирующие. FeCl3 применяют также в технологии пигментов и чернил и как протраву при крашении и набивке текстиля. Мелкодисперсный оксид железа(III) Fe2O3 (румяна, или венецианский кармин) — готовый абразив или пигмент.
Комплексные соединения
Ионы Fe(II) и Fe(III) образуют комплексные анионы, например гексацианоферрат(II)-ион Fe(CN)6 4- и гексацианоферрат(III)-ион Fe(CN)6 3- . Берлинская лазурь (синий пигмент) — гексацианоферрат(II) железа(III) Fe4[Fe(CN)6]3, турнбулева синь (также синий пигмент) — гексацианоферрат(III) железа(II) Fe3[Fe(CN)6]2. Комплексные ионы железа часто используют для обнаружения ионов железа(II) и железа(III) по результатам образования окрашенных комплексных соединений. Они применяются также в светокопировальной технике (цианотипная бумага): бумагу пропитывают раствором соли железа(III) и высушивают. При наложении на нее чертежа, выполненного на кальке, и выдержке на свету Fe(III) восстанавливается на освещенных местах до Fe(II) и после проявления бумаги в растворе гексацианоферрата образует комплексное соединение, окрашивающее засвеченные места бумаги в синий цвет. Цианотипная бумага передает изображение белыми линиями на синем фоне.
Литература
Конецкая Д.С. Введение // Железо высокой степени чистоты.. — Машиностороение, 1978.
Пикеринг Ф. Введение // Физическое металловедение и разработка сталей. — Машиностороение, 1982.



Отправить ответ