Каковы основные характеристики алюминия
Содержание:

Алюминий — серебристо-белый легкий металл. Расположен в III группе Периодической системы элементов Д.И.Менделеева под номером 13; атомная масса алюминия — 26,98. Конфигурация внешней электронной оболочки 3 s 2 Зр; атомный радиус — 0,143 мм, ионный радиус Аl 3+ (в скобках указаны координационные числа) 0,053 нм (4); 0,062 нм (5); 0,067 нм ( 6 ); сродство к электрону 0,5 эВ; электроотрицательность по Поллингу — 1,5; поперечное сечение захвата тепловых нейтронов — 215*10 -25 м 2 . Алюминий имеет кубическую гранецентрированную кристаллическую решетку с параметрами: а = 0,40403 нм, z = 4, пространственная группа Fm 3 m . В природе существует один стабильный изотоп 27 Аl .
Отличительные особенности алюминия — высокая электропроводимость, теплопроводность, коррозионная стойкость, малая плотность и отличная обрабатываемость давлением в холодном состоянии.
Физические свойства алюминия
Плотность (99,996% Аl), г/см 3 , при температуре:
Давление пара, Па, при температуре:
Удельная теплоемкость, Дж/(кг*К), при температуре:
Коэффициент линейного расширения при температуре 20-100 °С, К . 24,58*10 -6
Теплопроводность, Вт/( м*К), при температуре:
Электропроводность по отношению к меди при температуре 20 °С, % . 65,5
Удельное электросопротивление, мк*Ом*м. 0,0265
Температурный коэффициент электросопротивления. 0,042
Динамическая вязкость (99,85% Аl), Н*с/м 2 , при температуре:
11 23°С . 1,5* 10 -3
Модуль нормальной упругости Е, МПа, при температуре:
Модуль сдвига при температуре 20 °С, МПа. 2,7* 10 4
Магнитная характеристика алюминия. Слабо парамагнитен
Механические свойства алюминия
Временное сопротивление разрыву σв, МПа:
в отожженном состоянии. 50
в деформированном (холоднокатаном) состоянии. 115
Предел текучести σ 0,2 , МПа:
в отожженном состоянии. 50-80
в деформированном состоянии. 120
Предел усталости (500*10 6 циклов) σ -1 , МПа:
в отожженном состоянии. 40
в деформированном состоянии. 50
Предел ползучести, МПа, при температуре:
Предел прочности при срезе σ ср , МПа:
в отожженном состоянии. 60
в деформированном состоянии. 100
Относительное удлинение δ, %:
в отожженном состоянии. 30-40
в деформированном состоянии. 5-10
Относительное сужение Ψ, %:
в отожженном состоянии. 70-90
в деформированном состоянии. 50-60
Ударная вязкость при температуре 20 °С, МПа. 140
Твердость по Бринеллю, НВ:
в литом состоянии. 20
в отожженном состоянии. 25
в деформированном состоянии. 30-35
При охлаждении алюминия до температуры ниже 120 К его прочностные свойства в отличии от большинства металов возрастают, а пластичность не изменяется (табл. 1).
Табл. 1. Механические свойства алюминия различной чистоты
Состояние
Содержание Al , %
Предел прочности при растяжении, МПа
Предел текучести при растяжении, МПа
Относительное удлинение, %
Твердость по Бринеллю. НВ
99 , 9
99 , 5
99 , 0
99 , 0
99 , 0
98 , 0
Технологические свойства алюминия
горячей обработки. 350-450
Линейная усадка, %. ……………………….…. 2,7
Допускаемая деформация (холодная и горячая), % ……………. … 75-90
Начало рекристаллизации, °С. ……………………………..… 150
Жидкотекучесть, мм. ………………………… 317
Коррозионные свойства алюминия
Алюминий и его сплавы характеризуются высокой коррозионной стойкостью в атмосферных условиях как сельской местности, так и городских промышленных районов.
Сернистый газ, сероводород, аммиак и другие газы, находящиеся в воздухе промышленных районов, не оказывают заметного влияния на скорость коррозии алюминия и его сплавов. Алюминий практически не корродирует в дистиллированной и чистой пресной (естественной) воде даже при высоких температурах (до 180 °С). Действие пара на алюминий и его сплавы также незначительно.
Вода, содержащая примеси щелочей, резко повышает скорость коррозии алюминия. При комнатной температуре скорость коррозии алюминия в аэрированной воде содержащей 0 , 1 % едкого натрия — 16 мм/год; 0,1% соляной кислоты — 1 мм/год и 1% соды — 4 мм/год.
Алюминий и его сплавы, не содержащие меди, достаточно стойки в естественной (не загрязненной) морской воде. Сернокислые соли магния, натрия, алюминия, а также гипосульфит практически не действуют на технический алюминий. Скорость коррозии алюминия возрастает в присутствии в воде солей ртути, меди или ионов хлора, разрушающих защитную оксидную пленку на алюминии.
В концентрированной азотной кислоте при комнатной температуре алюминий и его сплавы устойчивы, но быстро разрушаются в разбавленных кислотах.
Слабые растворы серной кислоты, концентрацией до 10%, при комнатной температуре незначительно влияют на технический алюминий, но с повышением концентрации и температуры скорость коррозии резко возрастает. В концентрированной серной кислоте алюминий практически устойчив.
Соляная кислота быстро разрушает алюминий и его сплавы, особенно с повышением температуры. Такое ж e действие на алюминий оказывают растворы плавиковой и бромистоводородной кислот. Слабые растворы фосфорной (менее 1%), хромовой (до 10%) и борной (при всех концентрациях) кислот на алюминий и его сплавы действуют незначительно.
Органические кислоты — уксусная, масляная, лимонная, винная, а также кислые (незагрязненные) фруктовые соки, вино оказывают слабое действие на алюминий и его сплавы, за исключением щавелевой и муравьиной кислот.
Алюминий и его сплавы быстро разрушаются в растворах едких щелочей, однако в растворах , аммиака они довольно стойки, особенно сплавы, содержащие магний. Амины на них действуют также незначительно.
Следует отметить, что алюминий и однофазные сплавы на алюминиевой основе более стойки в коррозионном отношении, чем сплавы двухфазные и многофазные.
Влияние примесей на свойства алюминия
На коррозионные, физические, механические и технологические свойства алюминия оказывают значительное влияние примеси различных элементов. Так, например, большинство примесей снижают электропроводность алюминия (рис. 1 ) .
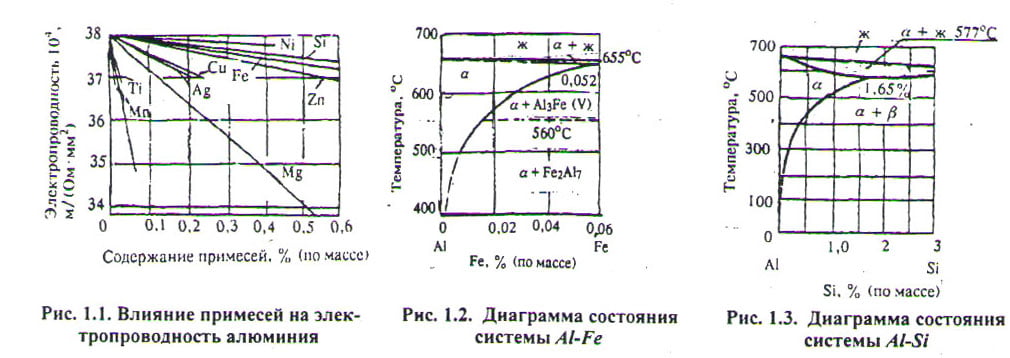
Основные примеси в алюминии — железо и кремний. Железо снижает коррозионную стойкость, электропроводность и пластичность алюминия, но несколько повышает его прочность. Диаграмма состояния системы Al — Fe , приведенная на рис. 2, показывает, что железо незначительно растворяется в алюминии в твердом состоянии. При температуре эвтектики (655°С) растворимость железа достигает 0,052% и с понижением температуры граница твердого раствора α резко сдвигается в сторону алюминия.
Железо в алюминии присутствует в виде самостоятельной фазы A 3 Fe . Железо — вредная примесь не только в алюминии, но и в сплавах алюминия с кремнием и магнием. Однако в жаропрочных алюминиевых сплавах железо (в сочетании с никелtм) является полезной примесью.
Обычная примесь в алюминии — кремний. В сплавах на алюминиевой основе кремний наряду с медью, магнием, цинком, а также марганцем, никелем и хромом вводится в качестве основного компонента. Образующиеся при этом соединения CAl 2 , Mg 2 Si , CuMgAl 2 и др. являются эффективными упрочнителями алюминиевых сплавов.
Из диаграммы состояния алюминий-кремний (рис. 3) видно, что при температуре эвтектики 577°С в алюминии растворяется до 1,65% кремния. С понижением температуры область твердого раствора а резко уменьшается.
Примеси кальция и других элементов, присутствующих в стандартных марках алюминия в незначительном количестве, не имеют практического значения. Небольшие добавки церия, натрия и титана оказывают существенное влияние на структуру и свойства определенных алюминиевых сплавов.
Водород хорошо растворяется в алюминии и оказывает отрицательное влияние на его свойства, вызывая при литье пористость. Азот при высоких температурах вступает в реакцию с алюминием с образованием тугоплавкого соединения.
Общая характеристика алюминия
Алюминий – самый распространенный в земной коре металл. Он входит в состав глин, полевых шпатов, слюд и многих других минералов. Общее содержание алюминия в земной коре составляет 8% (масс.).
Алюминий – серебристо-белый (рис. 1) легкий металл. Он легко вытягивается в проволоку и прокатывается в тонкие листы.
При комнатной температуре алюминий не изменяется на воздухе, но лишь потому, что его поверхность покрыта тонкой пленкой оксида, обладающего очень сильным защитным действием.

Рис. 1. Алюминий. Внешний вид.
Атомная и молекулярная масса алюминия
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии алюминий существует в виде одноатомных молекул Al, значения его атомной и молекулярной масс совпадают. Они равны 26,9815.
Изотопы алюминия
Известно, что в природе алюминий может находиться в виде одного стабильного изотопа 27 Al. Массовое число равно 27. Ядро атома изотопа алюминия 27 Al содержит тринадцать протонов и четырнадцать нейтронов.
Существуют радиоактивные изотопы алюминия с массовыми числами от 21-го до 42-х, среди которых наиболее долгоживущим является изотоп 26 Al, период полураспада которого составляет 720 тысяч лет.
Ионы алюминия
На внешнем энергетическом уровне атома алюминия имеется три электрона, которые являются валентными:
1s 2 2s 2 2p 6 3s 2 3р 1 .
В результате химического взаимодействия алюминий отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Молекула и атом алюминия
В свободном состоянии алюминий существует в виде одноатомных молекул Al. Приведем некоторые свойства, характеризующие атом и молекулу алюминия:
Энергия ионизации атома, эВ
Радиус атома, нм
Стандартная энтальпия диссоциации молекул при 25 o С, кДж/моль
Сплавы алюминия
Основное применение алюминия – производство сплавов на его основе. Легирующие добавки (например, медь, кремний, магний, цинк, марганец) вводят в алюминий главным образом для повышения его прочности.
Широкое применение имеют дуралюмины, содержащие медь и магний, силумины, в которых основной добавкой служит кремний, магналий (сплав алюминия с 9,5-11,5% магния).
Алюминий – одна из наиболее распространенных добавок в сплавах на основе меди, магния, титана, никеля, цинка и железа.
Примеры решения задач
| Задание | Для сварки рельсов по методу алюмотермии используют смесь алюминия и оксида железа Fe3O4. Составьте термохимическое уравнение реакции, если при образовании железа массой 1 кг (1000 г) выделяется 6340 кДж тепла. |
| Решение | Запишем уравнение реакции получения железа алюмотермическим методом: |
Найдем теоретическую массу железа (рассчитанная по термохимическому уравнению реакции):
m(Fe) = 9 × 56 = 504 г.
Пусть в ходе реакции выделится х кДж теплоты. Составим пропорцию:
1000 г – 6340 кДж;
Отсюда х будет равен:
х = 540 ×6340 / 1000 = 3195.
Значит в ходе реакции получения железа алюмотермическим методом выделяется 3195 кДж теплоты. Термохимическое уравнение реакции имеет вид:
| Задание | Алюминий обработали 200 г 16%-го раствора азотной кислоты, при этом выделился газ. Определите массу и объем выделившегося газа. |
| Решение | Запишем уравнение реакции растворения алюминия в азотной кислоте: |
Рассчитаем массу растворенного вещества азотной кислоты:
m(HNO3) = 20 ×96% / 100% =19,2 г.
Найдем количество вещества азотной кислоты:
M(HNO3) = Ar(H) + Ar(N) + 3×Ar(O) = 1 + 14 + 3×16 = 63 г/моль.
n(HNO3) = 19,2 / 63 = 0,3моль.
Согласно уравнению реакцииn(HNO3) :n(H2) = 6:3, т.е.
Тогда масса и объем выделившегося водорода будут равны:
M(H2) = 2×Ar(H) = 2×1 = 2 г/моль.
| Понравился сайт? Расскажи друзьям! |


 Коэффициент теплопроводности металла составляет около 0,50 кал/см*с*С и увеличивается со степенью его чистоты.
Коэффициент теплопроводности металла составляет около 0,50 кал/см*с*С и увеличивается со степенью его чистоты.


Отправить ответ