Молекулярная масса диоксида углерода
Содержание:

Углекислый газ и его физические свойства
Углекислый газ состоит из углерода и кислорода. Формула углекислого газа выглядит так – CO₂. В природе он образуется при сжигании или гниении органических веществ. В воздухе и минеральных источниках содержание газа также достаточно велико. кроме того люди и животные также выделяют диоксид углерода при выдыхании.

Рис. 1. Молекула углекислого газа.
Диоксид углерода является абсолютно бесцветным газом, его невозможно увидеть. Также он не имеет и запаха. Однако при его большой концентрации у человека может развиться гиперкапния, то есть удушье. Недостаток углекислого газа также может причинить проблемы со здоровьем. В результате недостатка это газа может развиться обратное состояние к удушью – гипокапния.
Если поместить углекислый газ в условия низкой температуры, то при -72 градусах он кристаллизуется и становится похож на снег. Поэтому углекислый газ в твердом состоянии называют «сухой снег».

Рис. 2. Сухой снег – углекислый газ.
Углекислый газ плотнее воздуха в 1,5 раза. Его плотность составляет 1,98 кг/м³ Химическая связь в молекуле углекислого газа ковалентная полярная. Полярной она является из-за того, что у кислорода больше значение электроотрицательности.
Важным понятием при изучении веществ является молекулярная и молярная масса. Молярная масса углекислого газа равна 44. Это число формируется из суммы относительных атомных масс атомов, входящих в состав молекулы. Значения относительных атомных масс берутся из таблицы Д.И. Менделеева и округляются до целых чисел. Соответственно, молярная масса CO₂ = 12+2*16.
n – число атомов или молекул.
Ar – относительная атомная масса химического элемента.
Mr – относительная молекулярная масса вещества.
Рассчитаем относительную молекулярную массу углекислого газа.
Химические и биологические свойства углекислого газа
Углекислый газ обладает кислотными свойствами, так как является кислотным оксидом, и при растворении в воде образует угольную кислоту:
Вступает в реакцию со щелочами, в результате чего образуются карбонаты и гидрокарбонаты. Этот газ не подвержен горению. В нем горят только некоторые активные металлы, например, магний.
При нагревании углекислый газ распадается на угарный газ и кислород:
Как и другие кислотные оксиды, данный газ легко вступает в реакцию с другими оксидами:
Углекислый газ входит в состав всех органических веществ. Круговорот этого газа в природе осуществляется с помощью продуцентов, консументов и редуцентов. В процессе жизнедеятельности человек вырабатывает примерно 1 кг углекислого газа в сутки. При вдохе мы получаем кислород, однако в этот момент в альвеолах образуется углекислый газ. В этот момент происходит обмен: кислород попадает в кровь, а углекислый газ выходит наружу.
Получение углекислого газа происходит при производстве алкоголя. Также этот газ является побочным продуктом при получении азота, кислорода и аргона. Применение углекислого газа необходимо в пищевой промышленности, где углекислый газ выступает в качестве консерванта, а также углекислый газ в виде жидкости содержится в огнетушителях.

Рис. 3. Огнетушитель.
Что мы узнали?
Углекислый газ – вещество, которое в нормальных условиях не имеет цвета и запаха. помимо своего обычного названия – углекислый газ, его также называют оксидом углерода или диоксидом углерода.
Углекислый газ формируется при соединении двух элементов: углерода и кислорода. Он образуется в процессе сжигания угля или углеводородных соединений, при ферментации жидкостей, а также как продукт дыхания людей и животных. В небольших количествах он содержится и в атмосфере, откуда он ассимилируется растениями, которые в свою очередь производят кислород. Углекислый газ бесцветен и тяжелее воздуха. Он не пригоден для поддержания жизни. Углекислый газ замерзает при температуре −78,5 °C с образованием снега, состоящего из двуокиси углерода. В виде водного раствора он образует угольную кислоту, однако она не обладает достаточной стабильностью для того, чтобы ее можно было легко изолировать.
Основное применение
| Диоксид углерода | |
|---|---|
   |
|
| Другие названия | углекислый газ, двуокись углерода, сухой лёд(твердый) |
| Формула | CO2 |
| Молярная масса | 44,0095(14) г/моль |
| В твердом виде | сухой лёд |
| Вид | бесцветный газ |
| Номер CAS | [] |
| Свойства | |
| Плотность и фазовое состояние | 1,9769 кг/м 3 , при н.у.; 771 кг/м 3 , жидкий; 1512 кг/м 3 , твёрдый |
| Растворимость в воде | 1,45 кг/м 3 |
| Удельная теплоемкость | 0,846 кДж/(кг*С) при 27 °C |
| Удельная теплота плавления | 25,13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6,35 и 10,33 |
| Вязкость | 0,07 пз при −78 °C |
| Строение | |
| Форма молекулы | линейная |
| Кристаллическая решётка | молекулярная |
| Дипольный момент | ноль |
| Техника безопасности | |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | |
| R: As, Fb [источник не указан 830 дней] |
|
| S9, S23, S36 (ж) | |
| RTECS number | FF6400000 |
| Страница дополнительных сведений | |
| Структура и свойства | n, εr, |
| Спектр | УФ, ИК, ЯМР, |
| Родственные соединения | |
| Оксиды | CO C3O2 C2O CO3 |
| Если не указано иное, данные даны для материалов при стандартных условиях (25 °C, 100 кПа) Infobox disclaimer and references |
|
Химическая отрасль
Углекислый газ используется при производстве синтетических химических веществ и регулировании реакторных температур.
CO2 также служит для нейтрализации щелочных сточных вод. В закритических условиях диоксид углерода используется в процессах очистки или осушки полимеров, волокон животного или растительного происхождения.
Фармацевтика
Углекислый газ используется для создания инертной среды, синтеза химических веществ, сверхкритической флюидной экстракции (SFE), подкисления (pH) сточных вод или продукта при их низкотемпературной транспортировке (−78 °C или −108 °F).
Пищевая отрасль
В пищевой отрасли выделяются следующие основные направления применения CO2
- Насыщение углекислотой шипучих напитков, в том числе безалкогольных напитков, минеральной воды и пива.
- Упаковка пищевых продуктов — инертные и бактерицидные свойства газа успешно используются в азотных смесях (упаковка в модифицированной атмосфере) для увеличения срока хранения многих продуктов питания (§ ALIGAL™).
- Процессы охлаждения или заморозки (в виде криогенной жидкости) и контроль температуры при распределении пищевых продуктов (в виде сухого льда).
- Удаление кофеина из кофе с использованием диоксида углерода в сверхкритическом состоянии.
Медицина
При проведении операций на искусственных органах углекислый газ служит для создания атмосферных условий, близких к физиологическим.
В качестве одного из компонентов кислородной или воздушной смеси углекислый газ служит стимулятором глубокого дыхания. Другим его применением является хирургическая дилатация при интраабдоминальных инсуффляциях.
Металлургическая отрасль
Наиболее популярным применением углекислого газа в металлургии является защита окружающей среды
- CO2 применяется для осаждения бурого дыма в процессах завалки лома и закачки углерода, для сокращения объема поглощения азота в процессе вскрытия электродуговых печей, а также для донного перемешивания.
- Отрасль переработки цветных металлов использует углекислый газ для осаждения дыма в процессе ковшовой транспортировки штейна (производство Cu/Ni) или слитков (производство Zn/Pb).
- Небольшое количество жидкого диоксида углерода может использоваться при рециркуляции воды в процессе отвода кислотных шахтных вод.
- Лазеры, использующие CO2, хорошо известны еще и как потребители некоторых специальных марок диоксида углерода (§ LASAL™).
Лабораторные исследования и анализ
Диоксид углерода в сверхкритическом состоянии представляет собой подвижную фазу, используемую как в процессе хроматографического анализа, так и в процессах экстрагирования.
отрасль
После щелочной отбелки древесной массы или целлюлозы диоксид углерода позволяет с высокой точностью регулировать уровень pH в переработанном сырье.
CO2 может использоваться в процессах нейтрализации талового масла и в целях повышения производительности бумагоделательных машин.
Электроника
Диоксид углерода стандартно применяется для обработки сточных вод, а в качестве охладителя он используется при испытании электронных приборов на воздействие окружающей среды.
Помимо этого диоксид углерода позволяет повышать проводимость сверхчистой воды, а в виде снега используется для абразивной очистки деталей или удаления осадков на кристаллических пластинах.
Дополнительно диоксид углерода может использоваться в качестве экологически чистой сверхкритической жидкости для удаления фототвердеющих материалов из кристаллических пластин без применения органических растворителей.
Охрана окружающей среды
Добавление диоксида углерода позволяет поддерживать необходимый уровень pH в жидких стоках. В качестве регулятора рН он является прекрасной альтернативой серной кислоте.
Приборы, посуда и реактивы: аппарат Киппа (с двумя промывными склянками); технохимические весы с разновесами; термометр комнатный; барометр; резиновое кольцо; сухая плоскодонная колба ёмкостью 250 мл с пробкой; мерный цилиндр на 300-500 мл; мрамор кусковой; соляная кислота (1:6); серная кислота (концентрированная); гидрокарбонат натрия (насы-щенный раствор).

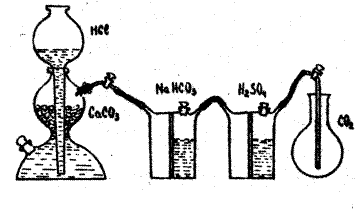
Установка для получения и очистки диоксида углерода
На технохимических весах взвесить сухую колбу с воздухом, закрытую пробкой (масса m1). Пробка должна быть вдвинута в горлышко колбы до метки (резиновое кольцо). Опустить в колбу стеклянную трубку, подводящую диоксид углерода из аппарата Киппа, открыть кран аппарата и медленно пропускать диоксид углерода в течение 7-8 мин. Закрыть колбу пробкой до метки и взвесить (m2). Вновь пропускать диоксид углерода 3-4 мин, а затем взвесить (m2). Если результаты двух последних взвешиваний равны или отличаются друг от друга не более чем на 0,01 г, то наполнение колбы считать законченным. В противном случае повторить наполнение и добиться постоянного результата взвешивания. Отметить температуру по комнатному термометру и давление — по барометру.
Определить объём колбы, наполнив её водой до метки, затем измерить объём воды мерным цилиндром и записать результаты в таблицу:
| Масса колбы с воздухом и пробкой, г | Масса колбы с CO2 и пробкой, г | Объём колбы, V мл | Температура, °С | Давление, Р мм рт. ст. |
1. Объём воздуха в колбе V следует привести к нормальным
условиям (То = 273 К, Ро = 760 мм рт. ст.) по формуле:
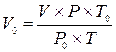 ,
,
где V — объём колбы, Р — атмосферное давление, Т — температура, К.
2. Вычислить массу воздуха m4, который находился в колбе, зная, что масса 1 л воздуха при нормальных условиях равна 1,29 г.
3. По разности (m1 – m4) вычислить массу пустой колбы с пробкой (m3).
4. По разности (m2 – m3) найти массу углекислого газа в колбе (m5).
5. Из найденных масс m4 и m5 определить относительную плотность диоксида углерода по воздуху: Dвозд = m5 / m4 .
6. Вычислить молекулярную массу углекислого газа (с точностью до 0,01 г):
а) по относительной плотности – M1, М1 = 29 × Dвозд;
б) по уравнению Менделеева-Клапейрона, М2, г;
в) по закону Авогадро, М3, г.
7. Определить среднюю молекулярную массу, Мср., г:
8. Определить абсолютную и относительную ошибки опыта. Составить уравнение реакции получения диоксида углерода.
Контрольные вопросы
1. Какие законы относят к основным стехиометрическим законам химии? В чем их сущность?
2. Какие величины характеризуют газовое состояние? Каковы единицы измерения массы, объёма, давления, температуры?
3. Что называется плотностью газа по воздуху? Как можно вычислить молекулярную массу вещества, зная плотность его паров по воздуху?
4. Какой вид примет формула для расчёта молекулярной массы газа, если относительную плотность его определить по азоту или по диоксиду углерода?
Дата добавления: 2015-10-21 ; просмотров: 1138 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ



Отправить ответ