Вольфрам знак в таблице менделеева
Содержание:
Вольфрам — элемент VI группы периодической системы химических элементов, его порядковый номер 74, атомная масса 183,85.
Природный вольфрам состоит из смеси стабильных изотопов с массами:
Для вольфрама также известны радиоактивные изотопы с массами от 174 до 188.
Делись добром 😉
Похожие главы из других работ:
Строение атома водорода в периодической системе
Первый элемент периодической системы (1-й период, порядковый номер 1). Не имеет полной аналогии с остальными химическими элементами и не принадлежит ни к какой группе, поэтому в таблицах условно помещается в IА группу и/или VIIA-группу.
I. Строение атомов металлов. Положение металлов в периодической системе. Группы металлов.
В настоящее время известно 105 химических элементов, большинство из них — металлы. Последние весьма распространены в природе и встречаются в виде различных соединений в недрах земли, водах рек, озер, морей, океанов, составе тел животных.
2.4 Периодическая система химических элементов и строение атома
Таблица Периодической системы химических элементов графически отображает Периодический закон.
3.1 Получение новых химических элементов
Вещественная среда обитания людей содержит многочисленные соединения и их составляющие — химические элементы. Еще до 30-х годов XX века Периодическая система Менделеева состояла из 88 элементов. С учетом свободных клеток с номерами 43 (технеций).
2. Размеры атомов. Связь размера атома с положением в периодической системе элементов. Понятие об ионах
Атом состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных частиц_электронов, составляющих его электронную оболочку. Сумма зарядов электронов равна по модулю положительному заряду ядра.
2. Характеристика по положению в периодической системе Д. И. Менделеева. Физические свойства
Что же представляет собой этот элемент? Магний — элемент II группы периодической системы Д. И. Менделеева; третьего периода, главной подгруппы, порядковый номер 12; атомная масса 24,312 у.е. Это легкий (плотность 1.
1. Биологическая роль химических элементов в организме
Биологическая роль химических элементов в организме человека чрезвычайно разнообразна. Главная функция макроэлементов состоит в построении тканей, поддержании постоянства осмотического давления, ионного и кислотно-основного состава.
2. Местоположение в периодической системе
Элемент побочной подгруппы шестой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 42. Обозначается символом Mo (лат. Molybdaenum).
1. Количественная оценка распределения химических элементов
Можно ли дать количественную оценку перераспределению химических элементов между природными объектами? Конечно, можно, если известно содержание элементов в сравниваемых объектах.
4. Процессы образование химических элементов
химический элемент кларк гелий Наиболее распространенной термоядерной реакцией является превращение водорода в гелий. Преобразование ядер водорода в ядра гелия сопровождается выделением огромной энергии. По мнению американского ученого О.
1.1.2 Положение цинка в периодической системе Д.И. Менделеева
Цинк — элемент побочной подгруппы второй группы, четвертого периода периодической системы химических элементов Д.И. Менделеев, с атомным номером 30. Атомная масса 65,39. Конфигурация внешних электронных оболочек атома 3d10 4s2. Степень окисления +2.
Ртуть — элемент таблицы периодической системы химических элементов Д. И. Менделеева
80 Ртуть Hg 200,59 4f145d106s2 Ртуть — элемент побочной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum) [1].
2.1. Характеристика кобальта по положению в периодической системе. Электронная формула
Со, химический элемент с атомным номером 27. Его атомная масса 58,9332. Природный кобальт состоит из двух стабильных нуклидов: 59Со (99,83% по массе) и 57Со (0,17%). В периодической системе элементов Д. И.
5. Валентность химических элементов
Способность атомов присоединять определенное число атомов других элементов называется валентностью элемента. С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента.
3. Сравнение химических свойств простых элементов
Свойства элементов группы VA К элементам V группы главной подгруппы относятся: азот, фосфор, мышьяк, сурьма, висмут.
Общие сведения о строении атома вольфрама
Относится к элементам d-семейства. Металл. Обозначение – W. Порядковый номер – 74. Относительная атомная масса – 183,84 а.е.м.
Электронное строение атома вольфрама
Атом вольфрама состоит из положительно заряженного ядра (+74), внутри которого есть 74 протона и 109 нейтронов, а вокруг, по шести орбитам движутся 74 электрона.
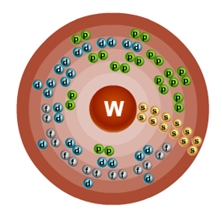
Рис.1. Схематическое строение атома вольфрама.
Распределение электронов по орбиталям выглядит следующим образом:
Внешний энергетический уровень атома вольфрама содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
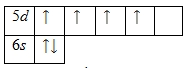
Валентные электроны атома вольфрама можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева, обозначается символом W (лат. Wolframium). При нормальных условиях представляет собой твёрдый блестящий серебристо-серый переходный металл.
Вольфрам — самый тугоплавкий из металлов. Более высокую температуру плавления имеет только неметаллический элемент — углерод. При стандартных условиях химически стоек.
История происхождения названия
Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья пена» — «Spuma lupi» на латыни, или «Wolf Rahm» по-немецки. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирает олово как волк овцу»).
В настоящее время в США, Великобритании и Франции для вольфрама используют название «tungsten» (швед. tung sten — «тяжелый камень»).
В 1781 году знаменитый шведский химик Шееле, обрабатывая азотной кислотой минерал шеелит, получил жёлтый «тяжёлый камень» (триоксид вольфрама). В 1783 году испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита как растворимой в аммиаке жёлтой окиси нового металла, так и самого металла. При этом один из братьев, Фаусто, был в Швеции в 1781 году и общался с Шееле. Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
Получение
Сырьём для получения Вольфрама служат вольфрамитовые и шеелитовые концентраты (50-60% WO3).
Из концентратов непосредственно выплавляют ферровольфрам (сплав железа с 65-80% Вольфрама), используемый в производстве стали; для получения Вольфрама, его сплавов и соединений из концентрата выделяют вольфрамовый ангидрид.
В промышленности применяют несколько способов получения WО3:
1. Шеелитовые концентраты разлагают в автоклавах раствором соды при 180-200°С (получают технический раствор вольфрамата натрия) или соляной кислотой (получают техническую вольфрамовую кислоту):
Вольфрамитовые концентраты разлагают либо спеканием с содой при 800-900°С с последующим выщелачиванием Na2WO4 водой, либо обработкой при нагревании раствором едкого натра. При разложении щелочными агентами (содой или едким натром) образуется раствор Na2WO4, загрязнённый примесями. После их отделения из раствора выделяют H2WO4. Для получения более грубых, легко фильтруемых и отмываемых осадков вначале из раствора Na2WO4 осаждают CaWO4, который затем разлагают соляной кислотой. Высушенная H2WO4 содержит 0,2 — 0,3% примесей.
Прокаливанием H2WO4 при 700-800°С получают WO3, а уже из него — твёрдые сплавы.
2. Для производства металлического Вольфрама H2WO4 дополнительно очищают аммиачным способом — растворением в аммиаке и кристаллизацией паравольфрамата аммония 5(NH4)2O·12WO3·nH2O. Прокаливание этой соли даёт чистый WO3.
3. Порошок Вольфрама получают восстановлением WO3 водородом (а в производстве твёрдых сплавов — также и углеродом) в трубчатых электрических печах при 700-850°С. Компактный металл получают из порошка металлокерамическим методом, то есть прессованием в стальных пресс-формах под давлением 3000-5000 (кг*с/см 2 )и термической обработкой спрессованных заготовок — штабиков. Последнюю стадию термической обработки — нагрев примерно до 3000°С проводят в специальных аппаратах непосредственно пропусканием электрического тока через штабик в атмосфере водорода. В результате получают Вольфрам, хорошо поддающийся обработке давлением (ковке, волочению, прокатке и т. д.) при нагревании.
Вольфрам — блестящий светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). Температура плавления — 3695 K (3422 °C), кипит при 5828 K (5555 °C). Плотность чистого вольфрама составляет 19,25 г/см³. Обладает парамагнитными свойствами. Твёрдость по Бринеллю 488 кг/мм², удельное электрическое сопротивление при 20 °C — 55·10−9 Ом·м, при 2700 °C — 904·10−9 Ом·м. Хорошо поддаётся ковке и может быть вытянут в тонкую нить.
Имеет валентность II, III и VI. Наиболее устойчив VI валентный вольфрам. II, III валентные соединения вольфрама неустойчивы и практического значения не имеют.
В обычных условиях Вольфрам химически стоек. При 400-500°С окисляется на воздухе до WO3. Пары воды интенсивно окисляют его выше 600°С до WO3. Галогены, сера, углерод, кремний, бор взаимодействуют с Вольфрамом при высоких температурах (фтор с порошкообразным вольфрамом — при комнатной). С водородом Вольфрам не реагирует вплоть до температуры плавления; с азотом выше 1500°С образует нитрид. При обычных условиях Вольфрам стоек к соляной, серной, азотной и плавиковой кислотам, а также к царской водке; при 100°С слабо взаимодействует с ними; быстро растворяется в смеси плавиковой и азотной кислот.

В растворах щелочей при нагревании Вольфрам растворяется слегка, а в расплавленных щелочах при доступе воздуха или в присутствии окислителей — быстро; при этом образуются вольфраматы.


Вольфрам образует четыре оксида:
высший — WO3 (вольфрамовый ангидрид),
Вольфрамовый ангидрид — кристаллический порошок лимонно-жёлтого цвета, растворяющийся в растворах щелочей с образованием вольфраматов. При его восстановлении водородом последовательно образуются низшие оксиды и вольфрам.
Вольфрамовому ангидриду соответствует вольфрамовая кислота H2WO4 — желтый порошок, практически не растворимый в воде и в кислотах. При ее взаимодействии с растворами щелочей и аммиака образуются растворы вольфраматов. При 188°С Н2WО4 разлагается с образованием WO3 и воды.
С хлором вольфрам образует ряд хлоридов и оксихлоридов. Наиболее важные из них: WCl6 (tпл 275°С, tкип 348°C) и WO2Cl2 (tпл 266°С, выше 300°С сублимирует), получаются при действии хлора на вольфрамовый ангидрид в присутствии угля.


С серой вольфрам образует два сульфида WS2 и WS3.


Карбиды вольфрама WC (tпл2900°C) и W2C (tпл 2750°С) — твердые тугоплавкие соединения; получаются при взаимодействии Вольфрама с углеродом при 1000-1500°С



Отправить ответ