Взаимодействие железа с водой при высоких температурах
Содержание:
В химическом отношении железо, кобальт и никель относятся к металлам средней активности. В электрохимическом ряду напряжений металлов они располагаются левее водорода, между цинком и оловом. Чистые металлы при комнатной температуре довольно устойчивы, их активность сильно увеличивается при нагревании, особенно если они находятся в мелкодисперсном состоянии. Наличие примесей значительно снижает устойчивость металлов.
-
Взаимодействие с неметаллами
При нагревании на воздухе выше 200 °С железо взаимодействует с кислородом, образуя оксиды нестехиометрического состава FexO, мелкодисперсное железо сгорает с образованием смешанного оксида железа (II, III):
Кобальт и никель реагируют с кислородом при более высоких температурах, образуя в основном оксиды двухвалентных элементов, имеющие переменный состав в зависимости от условий получения:
С галогенами металлы реагируют, образуя галогениды :
Металлы довольно устойчивы к действию фтора, никель не разрушается фтором даже при температуре красного каления.
При взаимодействии с азотом при невысокой температуре железо, кобальт и никель образуют нитриды различного состава, например:
Взаимодействие с серой экзотермично и начинается при слабом нагревании, в результате образуются нестехиометрические соединения, которые имеют состав, близкий к ЭS:
С водородом металлы триады железа не образуют стехиометрических соединений, но они поглощают водород в значительных количествах.
С углеродом, бором, кремнием, фосфором также при нагревании образуют соединения нестехиометрического состава, например:
Взаимодействие с водой
В воде в присутствии кислорода железо медленно окисляется кислородом воздуха (корродирует):
При температуре 700–900 °С раскаленное железо реагирует с водяным паром:
Кобальт и никель с водой не взаимодействуют.
Взаимодействие с кислотами
Железо реагирует с разбавленными растворами соляной и серной кислот, образуя соли железа (II):
с разбавленной азотной кислотой образует нитрат железа (III) и продукт восстановления азотной кислоты, состав которого зависит от концентрации кислоты, например:
При обычных условиях концентрированные (до 70 мас. %) серная и азотная кислоты пассивируют железо. При нагревании возможно взаимодействие с образованием солей железа (III):
По отношению к кислотам кобальт и никель устойчивее железа, медленно реагируют с неокисляющими кислотами с образованием солей кобальта (II) и никеля (II) и водорода. С разбавленной азотной кислотой образуют нитраты кобальта (II) и никеля (II) и продукт восстановления азотной кислоты, состав которого зависит от концентрации кислоты:
При обычных условиях концентрированные серная и азотная кислоты пассивируют кобальт и никель, хотя в меньшей степени, чем железо. При нагревании возможно взаимодействие с образованием солей железа двухвалентных металлов:
Взаимодействие со щелочами
Разбавленные растворы щелочей на металлы триады железа не действуют. Возможно только взаимодействие железа с щелочными расплавами сильных окислителей:
Для кобальта и никеля взаимодействие с расплавами щелочей не характерно.
Железо, кобальт и никель вытесняют металлы, которые расположены правее в электрохимическом ряду напряжений их растворов солей:
Для металлов триады железа характерно образование карбонилов, в которых железо, кобальт и никель имеют степень окисления, равную 0. Карбонилы железа и никеля получаются при обычном давлении и температуре 20–60 °С:
Карбонилы никеля образуются при давлении 2·10 7 – 3·10 7 Па и температуре 150–200 °С:
Разделы: Химия
Цель: на основании положения в периодической системе химических элементов, строения атома железа учащиеся должны составить представление о физических и химических свойствах железа.
Реактивы. На демонстрационном столе опилки железа, серная кислота (разбавленная), раствор сульфата меди (2), речной песок, вода дистиллированная. Штатив с пробирками, пипетки, пробка с газоотводной трубкой, стакан, лабораторный штатив, спиртовка.
На ученических столах — серная кислота (разбавленная), сульфат меди (2), опилки железные, штатив с пробирками, пипетки.
Оборудование: карта «Минеральные ресурсы» и таблица «План урока». Коллекция «Полезные ископаемые»; 3 конверта с заданиями.
Ход урока
1. Изучение нового материала.
УЧИТЕЛЬ. Ребята! Послушайте отрывок из «Поэмы о периодическом законе», В. Половняк.
Громоподобные раскаты
И в небе раскаленный след:
На землю новый камень падал
И ужасался человек
Но редким был подарок неба
Им лишь счастливец обладал:
Топор был выкован железный,
Сверкает лезвием кинжал.
Вот длинный ряд тысячелетний
Приходит в поисках, в борьбе,
И наступает век железный
Кровавый беспокойный век.
Проблемный вопрос: на каком древнем языке железо именуют «небесным камнем»?
(ученики выдвигают версии на поставленный вопрос).
Сообщение ученика. 30 июня 1908 году эвенка Чучанги рассказывал: тут я увидел страшное диво — лесины падают, хвоя горит. Жарко очень. Жарко сгореть можно. Вдруг над горой, где уже упал лес, стало сильно светло, будто второе солнце появилось. Эту местность эвенки стали называть «страной мертвого леса», площадь радиусом 25-30 км после падения метеорита.
При падении Тунгусского метеорита по всей Центральной Сибири был виден ослепительно-яркий свет. Установлено, что в земную атмосферу со скоростью 70 км/с влетело метеоритное тело массой 1000000 т. Удары огромной силы, подобные взрывам, были слышны, в тысяче километров от места падения! Куски «небесного тела», которые называют «метеоритами», бывают похожи на камни черно-бурого цвета. В свободном состоянии железо встречается только в метеоритах. Ежесуточно на Землю выпадают до 10 т метеоритного вещества.[3]
УЧИТЕЛЬ. Итак, запишите в свои тетради тему урока: Железо. Строение атома, физические и химические свойства.
Цель урока: на основании положения в периодической системе химических элементов, строение атома железа составить представление о физических и химических свойствах железа.
1. Строение и свойства атомов.
Что можно дополнительно сказать о железе на основании положения его в периодической системе химических элементов? (Ученики сообщают — 8 группа, побочная подгруппа, 4 большой период, d-элемент. Химическое знак – Fe. Порядковый номер – 26. Относительная атомная масса (Ar) – 56).
УЧИТЕЛЬ. А теперь я прошу вас написать строение атома, электронную и графическую формулы железа?( к доске приглашаются ученики).
Ученики составляют следующую запись:
Электронная формула атома 1s 2 2s 2 p 6 3s 2 p 6 4s 2 3d 6 .
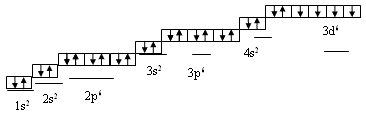
В соединениях железо проявляет степень окисления, в основном +2 и +3, реже +4 и +6. Как и всегда при изучении соединений, мы рассмотрим физические свойства железа:
2. Физические свойства железа.
Вашим помощником на этом уроке будет таблица «План урока», которая висит на доске ( см. приложение). Прошу вас использовать ее в работе на сегодняшнем уроке. (Учитель демонстрирует опилки железа). Начнем с физических свойств железа. Блестящий серебристо-белый металлический. Один из наиболее распространенных элементов в природе, по содержанию в земной коре (4,65% по массе) уступает лишь кислороду, кремнию и алюминию. Оно входит в состав многих оксидных руд – гематита, или красного железняка Fe2O3, магнетита Fe3O4, пирита FeS2 и др.
Комментируя руды, учитель демонстрирует коллекцию «Полезные ископаемые» и просит учеников на карте «Минеральные ресурсы», найти основные месторождения и назвать их?
УЧИТЕЛЬ. Сравним атомный радиус железа 0,126 нм с атомным радиусом натрия 0,186 нм, магния 0,16 нм, алюминии 0,14 нм. Какое влияние на свойства железа оказывает такие размеры атома и возможность отдавать электроны c внешнего и предпоследнего слоя?
Железо, имеющее атомы небольших размеров и большое число электронов, участвующих в металлической связи, должно обладать высокой температурой плавления и значительной твердостью, но вместе с тем сравнительно небольшой электропроводностью. Железо тугоплавкое – tпл = 1539°С, относительно мягкое (по школе твердость его равна 4), способен сильно притягиваться магнитами.
У железа есть две аллотропные модификации: альфа-железа устойчивое до 910°С, имеет кубическую объемно-центрированную решетку; гамма-железо t=910 – 1400°С – кубическую гранецентрированную.
Железо может отдавать электроны, находящиеся на двух ( внешнем и предпоследнем) слоях. Проявляет восстановительные свойства. Степень железа зависит от окислительной способности реагирующих с ним веществ. Итак, химические свойства железа:
3. Химические свойства железа.
Познакомимся с химическими свойствами железа: искры, вырывающиеся при резке стального инструмента, представляет с собой раскаленные частички окалины. В кислороде железо сгорает, разбрасывая искры – частички железной окалины Fe3O4.
Свойства №1 Взаимодействия железа с кислородом:
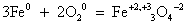
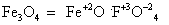 промежуточный оксид
промежуточный оксид
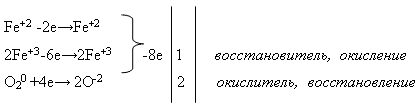
Свойства №2 Взаимодействие железа с водой:
Учитель пишет на доске уравнение реакции и просит уравнять его с помощью электронного баланса. Это задание выполняет ученик у доски, а остальные – на своих рабочих местах:
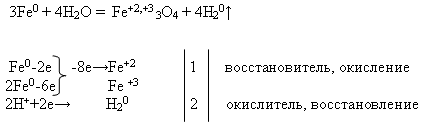
Затем учитель проводит демонстрацию опыта «Взаимодействия железа с водой» (см. приложение).
Свойство №3 Взаимодействие железа с разбавленными кислотами:
УЧИТЕЛЬ. Используя предложенные вам реактивы, проведите химическую реакцию, о которой идет речь. Напишите уравнение реакции в молекулярном и ионном виде. Докажите, что железо в данном процессе проявляет свойство восстановителя.
Учитель приглашает к доске ученика, который проводит эксперимент и записывает уравнение реакции, а остальные выполняют предложенное задание на своих рабочих местах:
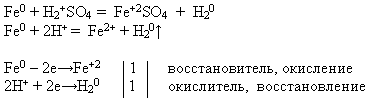
В электрохимическом ряду напряжений металлов железо расположено до водорода. Поэтому оно растворяется в разбавленных серной и соляной кислотах, вытесняя из них водород и образуя соответствующую соль, степень окисления +2.
Свойства №4 Взаимодействие с растворами солей:
УЧИТЕЛЬ. Используя предложенные вам реактивы, проведите химическую реакцию, о которой идет речь. Напишите уравнение реакции в молекулярном и ионном виде – это задание делают ученики первого варианта, а ученики второго варианта – докажите, что железо в данном процессе проявляет свойство восстановителя.
Учитель приглашает к доске ученика, который проводит эксперимент. А остальные выполняют предложенное задание на своих рабочих местах:
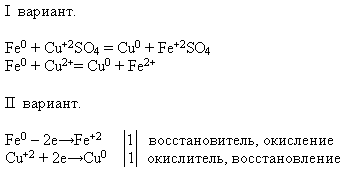
2. Подведем итоги урока по таблице «План урока»
3. Закрепление материала.
УЧИТЕЛЬ. Ребята! К нам на урок химии прислали три конверта, в них помещены задания для тех, кто хочет получить отметку «5» и «4». Приглашаю к доске желающих. Ученикам, работающим на своих местах, можно выполнить задание по своему усмотрению.
№1 конверт (за правильно выполненное задание – «5»).
Какой объем оксида углевода (2) потребуется для восстановления железа из 2,32 кг магнитного железа (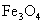 ), содержащего 5% пустой породы? Какое количество вещества железа при этом получится, если выход его составляет 80% от теоретически возможного? ), содержащего 5% пустой породы? Какое количество вещества железа при этом получится, если выход его составляет 80% от теоретически возможного? |
№2 конверт (за правильное выполненное задания – «4»).
Напишите два уравнения реакции железа с концентрированной серной кислотой, в которой продуктом восстановления кислоты будет соответственно оксид серы(4)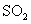 , сера S. При уравнивании записей реакции используйте метод электронного баланса. Определите окислитель и восстановитель в этих реакциях. , сера S. При уравнивании записей реакции используйте метод электронного баланса. Определите окислитель и восстановитель в этих реакциях. |
УЧИТЕЛЬ. Ребята! У нас еще остался конверт (учитель показывает конверт). Что же здесь находится? (Учитель вскрываетконверт и читает). Домашнее задание (записывает на доске домашнее задание).
Учить §14 до статьи «Соединение железа», по рабочей тетради тема «Железо» №3-4 письменно.
Завершая знакомство со свойствами железа, хочу напомнить, насколько химия многолика. Она дает ученику огромные возможности, но при этом требует ответственного отношения и понимания химических реакций. Надеюсь, что полученные сведения окажутся вам полезными.
Комментирую отметки учащихся.
Железо – химический элемент
1. Положение железа в периодической таблице химических элементов и строение его атома
Железо — это d- элемент VIII группы; порядковый номер – 26; атомная масса Ar ( Fe ) = 56; состав атома: 26-протонов; 30 – нейтронов; 26 – электронов.
Схема строения атома:

Электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Металл средней активности, восстановитель:
Fe 0 -2 e — → Fe +2 , окисляется восстановитель
Fe 0 -3 e — → Fe +3 , окисляется восстановитель
Основные степени окисления: +2, +3

2. Распространённость железа
Железо – один из самых распространенных элементов в природе . В земной коре его массовая доля составляет 5,1%, по этому показателю оно уступает только кислороду, кремнию и алюминию. Много железа находится и в небесных телах, что установлено по данным спектрального анализа. В образцах лунного грунта, которые доставила автоматическая станция “Луна”, обнаружено железо в неокисленном состоянии.
Железные руды довольно широко распространены на Земле. Названия гор на Урале говорят сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят соединения железа.
Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30-70% и более.
Основными железными рудами являются :
магнетит (магнитный железняк) – Fe3O4 содержит 72% железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии:


гематит (железный блеск, кровавик)– Fe2O3 содержит до 65% железа, такие месторождения встречаются в Криворожском районе:


лимонит (бурый железняк) – Fe2O3*nH2O содержит до 60% железа, месторождения встречаются в Крыму:

пирит (серный колчедан, железный колчедан, кошачье золото) – FeS2 содержит примерно 47% железа, месторождения встречаются на Урале.

3. Роль железа в жизни человека и растений
Биохимики открыли важную роль железа в жизни растений, животных и человека. Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных. В организме взрослого человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина. Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном направлении – CO2.
Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет.
Так от одной и той же причины – наличия железа в соках и тканях – весело зеленеют листья растений и ярко румянятся щеки человека.
4. Физические свойства железа.
Железо – это серебристо-белый металл с температурой плавления 1539 о С. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
Различают химически чистое и технически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02 -0,04% углерода, а кислорода, серы, азота и фосфора – еще меньше. Химически чистое железо содержит менее 0,01% примесей. Химически чистое железо – серебристо-серый, блестящий, по внешнему виду очень похожий на платину металл. Химически чистое железо устойчиво к коррозии и хорошо сопротивляется действию кислот. Однако ничтожные доли примесей лишают его этих драгоценный свойств.
Восстановлением из оксидов углём или оксидом углерода (II), а также водородом:
6. Химические свойства железа
Как элемент побочной подгруппы железо может проявлять несколько степеней окисления. Мы рассмотрим только соединения, в которых железо проявляет степени окисления +2 и +3. Таким образом, можно говорить, что у железа имеется два ряда соединений, в которых оно двух- и трехвалентно.
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
2) Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II,III) — вещество чёрного цвета:
3) При высокой температуре (700–900°C) железо реагирует с парами воды:
4) Железо реагирует с неметаллами при нагревании:
5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
6) В концентрированных кислотах – окислителях железо растворяется только при нагревании
На холоде концентрированные азотная и серная кислоты пассивируют железо!
7) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
8) Качественные реакции на
Основная часть получаемого в мире железа используется для получения чугуна и стали — сплавов железа с углеродом и другими металлами. Чугуны содержат около 4% углерода. Стали содержат углерода менее 1,4%.
Чугуны необходимы для производства различных отливок — станин тяжелых машин и т.п.
Стали используются для изготовления машин, различных строительных материалов, балок, листов, проката, рельсов, инструмента и множества других изделий. Для производства различных сортов сталей применяют так называемые легирующие добавки, которыми служат различные металлы: М n , С r , Мо и другие, улучшающие качество стали.
Задания для закрепления
№1. Составьте уравнения реакций получения железа из его оксидов Fe2O3 и Fe3O4 , используя в качестве восстановителя:
а) водород;
б) алюминий;
в) оксид углерода (II).
Для каждой реакции составьте электронный баланс.
№2. Осуществите превращения по схеме:
Fe2O3 -> Fe — +H2O, t -> X — +CO, t -> Y — +HCl -> Z
Назовите продукты X, Y, Z?



Отправить ответ